
БИБЛИОТЕКА
МАНИПУЛЯЦИИ
ЗАБОЛЕВАНИЯ
БАЗОВЫЕ ВОПРОСЫ
КУРОРТОЛОГИЯ
ССЫЛКИ
О САЙТЕ
Роль нарушений гемостаза
Патогенетическим компонентом позднего токсикоза беременных является синдром ДВС, развивающийся на фоне хронических нарушений периферического кровообращения, изменения реологических свойств крови, лизиса эритроцитов, адгезии и агрегации тромбоцитов. Характерным признаком синдрома ДВС является тромбоцитопения, которая всегда сопутствует тяжелым формам позднего токсикоза. По данным G. Weenink и соавт. (1985), у беременных с тяжелыми формами позднего токсикоза продолжительность жизни тромбоцитов сокращена до 5,1±0,3 дня по сравнению с 8,9±0,2 дня у здоровых беременных женщин. По данным F. Leiberman и соавт. (1985), о разрушении тромбоцитов при позднем токсикозе беременных свидетельствует повышение концентрации β-тромбоглобулина (4 фактор тромбоцитов) в плазме (незначительное) и моче (резкое).
Как показали исследования последних лет, регуляция агрегатного состояния крови достигается равновесием между синтезом простациклина (ПЦ) и тромбоксанов (ТХ). Простациклин относится к классу простагландинов и является ПГI2, синтезируется в эндотелии сосудов из свободных жирных кислот - линолевой, арахидоновой, входящих в фосфолипидный комплекс клеточных мембран, оказывает влияние на системный кровоток, являясь вазодилататором и ингибитором агрегации тромбоцитов. Тромбоксаны А и В, синтезирующиеся из того же предшественника, являются антагонистами ПЦ, обладают сосудосуживающим действием, способствуют агрегации тромбоцитов. Нарушение равновесия между тромбоксанами и ПЦ, способствуя указанным сосудистым изменениям, имеет большое значение в генезе артериальной гипертензии, синдрома ДВС и других сосудистых изменений у беременных с поздним токсикозом [Graeff H. et al., 1984; Yamaguchi M., Mori N., 1985 и др.]. В. Spitz и соавт. (1985) обнаружили угнетение синтеза ПЦ у животных, получавших корм с недостаточным содержанием витамина Е. Одновременно у них отмечены задержка развития плодов, появление симптомов, характерных для эклампсии. В развитии дефицита ПЦ некоторые авторы придают значение снижению поступления в организм незаменимых жирных кислот, в частности арахидоновой [Михайленко Е. Т., Чернега М. Я., 1985, и др.]. По данным S. Walsh (1985), при позднем токсикозе беременных в плаценте образуется в три раза больше тромбоксана В2 и в два раза меньше простациклина, чем при неосложненном течении беременности. Учитывая значение снижения синтеза ПЦ в развитии позднего токсикоза, F. Van Assche и соавт. (1984) применяют для его лечения дазоксибен, являющийся ингибитором тромбоксансинтетазы, а F. Moodley и соавт. (1984) считают эффективными при эклампсии инфузии простациклина.
По данным Т. В. Первовой (1986), синтез тромбоксана А2 и эндоперекисей простагландинов осуществляется при воздействии органоспецифического антигена плаценты - плацентарного α2-МГФ, содержание которого повышено в крови беременных с нефропатией. Плацентарный α2-МГФ вызывает необратимую агрегацию тромбоцитов даже в небольших количествах, что, по мнению автора, связано с высвобождением из фосфолипидов тромбоцитарной мембраны арахидоновой кислоты и индукцией ряда последовательных реакций, заканчивающихся синтезом тромбоксана А2 и простагландинов. Последние приводят к процессу тромбообразования, при котором из циркуляции выключаются наиболее активные тромбоциты. Активация тромбоцитов, выявляемая с помощью реакции агрегации, вызванной адреналином, коллагеном и особенно аденозиндифосфатом (АДФ), нарастает параллельно тяжести позднего токсикоза. Однако в случаях преэклампсии, эклампсии, токсикоза на фоне экстрагенитальной патологии гиперагрегация тромбоцитов сменяется глубоким угнетением их функции (гипоагрегация). Аналогичные данные несколько ранее были получены Л. С. Персианиновым и соавт. (1978). Этими авторами также отмечено повышение адгезивных, агрегационных свойств тромбоцитов при токсикозе средней тяжести и тяжелых формах. В то же время при эклампсии и постэклампсических состояниях наблюдается угнетение агрегационно-адгезивных свойств тромбоцитов, что авторы объясняют ингибиторным действием низкомолекулярных продуктов деградации фибрина, неизбежных спутников синдрома ДВС, на функцию тромбоцитов. А. Д. Макацария (1983) отмечает, что гипоагрегация тромбоцитов характерна для подострой и острой форм синдрома ДВС и является следствием как уменьшения числа тромбоцитов, так и их гипофункции за счет истощения вследствие предыдущего воздействия на них тромбоксана, аденозиндифосфата, простагландинов, адреналина и других стимуляторов агрегации тромбоцитов.
M. Moore, C. Redman (1983) обратили внимание на то, что беременные с поздним токсикозом и сопутствующей тромбоцитопенией нередко отмечали наличие мигреней до наступления беременности. Их обследование вне беременности и во время периода, свободного от головных болей, выявило высокую, превышающую нормальную, спонтанную агрегацию и адгезию тромбоцитов, а также тромбоцитопению во время приступов головной боли.
S. Thiagarajah и соавт. (1984) наблюдали 13 беременных, у которых тяжелый токсикоз с нарушением функции печени, почек сопровождался выраженной тромбоцитопенией. У всех больных отмечены или симптомы преэклампсии, или приступы судорог и другие осложнения (отслойка сетчатки, паралич черепных нервов). Назначение кортикостероидов способствовало улучшению функции печени и увеличению числа тромбоцитов. Прогрессирующая тромбоцитопения являлась основанием для досрочного родоразрешения.
Согласно собственным данным, степень тромбоцитопении находится в зависимости от тяжести позднего токсикоза. У здоровых беременных число тромбоцитов снижается к III триместру, оставаясь в пределах нижних границ нормального значения (табл. 10).
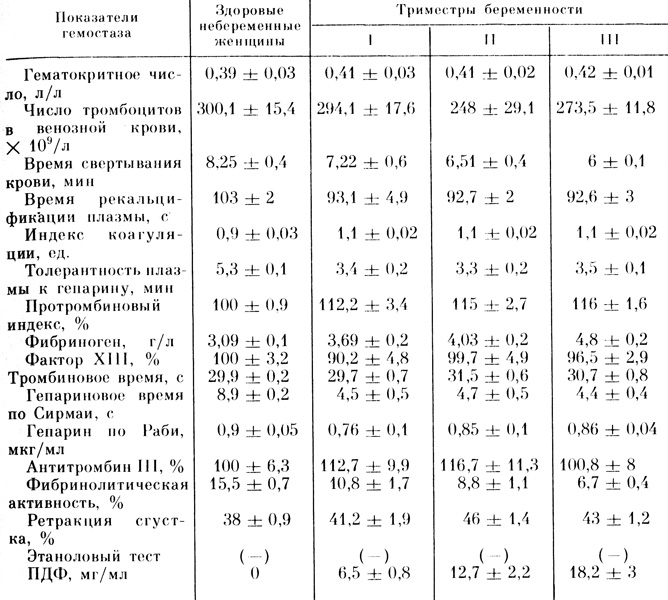
Таблица 10. Показатели гемостаза у здоровых беременных (Х̄±sх̄)
В случаях тяжелого токсикоза тромбоцитопения сохраняется и в послеродовом периоде. При необратимых состояниях, связанных с тяжелым токсикозом, тромбоцитопения сохраняется вплоть до гибели (табл. 11), хотя не всегда одинаково выражена, и число тромбоцитов колеблется от 30 до 150·109/л и более.
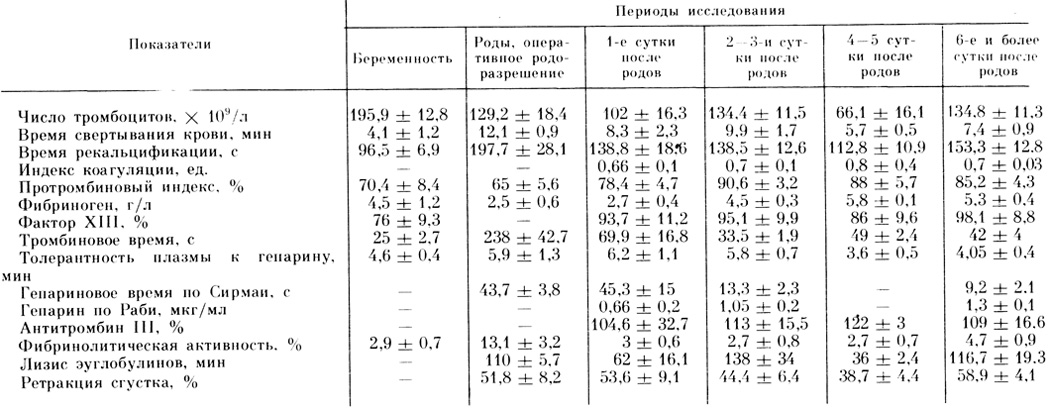
Таблица 11. Показатели гемостаза у погибших в результате позднего токсикоза беременных (Х̄±sх̄)
Таким образом, значение сосудисто-тромбоцитарных факторов в патогенезе позднего токсикоза, развитии необратимых изменений микрокровотока на сегодня хорошо известно. Не случайно контроль за числом тромбоцитов у беременных женщин включают в скрининг для диагностики позднего токсикоза, а изменения в системе гемостаза считают более надежным критерием тяжести токсикоза, чем имеющаяся иногда стертая клиническая картина [Репина М. А. и др., 1986, и др.].
Индукция сосудисто-тромбоцитарного звена гемостаза у беременных с поздним токсикозом приводит к потреблению в первую очередь функционально-активных, полноценных тромбоцитов. Потребление тромбоцитов в области микроциркуляции приводит к высвобождению β-тромбоглобулина или пластиночного фактора 4, обладающего антигепариновой активностью. Поэтому повышение концентрации фактора 4 также создает благоприятные условия для внутрисосудистого тромбообразования [Socol M. et al., 1985]. Не случайно предложены и интенсивно разрабатываются такие методы профилактики и лечения позднего токсикоза и одновременно методы нормализации агрегатного состояния крови, профилактики и лечения синдрома ДВС у беременных с поздним токсикозом, как использование гепарина [Knuppel R., Montenegro R., 1983; Репина М. А. и др., 1986, и др.]. Вводят смесь тромбоцитов и концентрата антитромбина III [Treffers P., Smorenberg-Schoorl M., 1985]. Применяют ингибиторы тромбоксана и стимуляторы простациклинов, препараты, тормозящие агрегацию тромбоцитов: ацетилсалициловую кислоту, дипиридамол (курантил) в суточных дозах соответственно 60-80-150 и 300 мг. [Beaufns M. et al., 1985; Wallenburg H., 1986, и др.]. По данным Н. Wallenburg и соавт. (1986), назначение ацетилсалициловой кислоты в ежедневной дозе 60 мг с 28 до 40 нед беременности женщинам с положительным ответом на введение ангиотензина II (повышение диастолического АД на 20 мм рт. ст.) способствует профилактике позднего токсикоза беременных.
О внутрисосудистом свертывании крови свидетельствуют положительные тесты паракоагуляции: определение в плазме фибриногена В, продуктов деградации фибриногена и фибрина (ПДФ), тесты с этанолом, протамина сульфатом и др. Смысл данных методов заключается в выявлении фибрин-мономеров и их комплексов с фибринопептидами, фибриногеном, т. е. продуктов, появляющихся из фибриногена при воздействии на него тромбином. Определение ПДФ в крови, как качественное, так и количественное, свидетельствует о гиперкоагуляции, предтромботическом состоянии, синдроме ДВС.
Согласно Н. Graeff и соавт. (1976), концентрация растворимых комплексов мономеров фибрина (РКМФ) значительно повышена в раннем послеродовом и послеродовом периодах, снижаясь спустя 3 мес. после родов. Определение высоких концентраций РКМФ свидетельствует о гиперкоагуляции и может помочь в раннем диагнозе тромбозов. Повышение РКМФ и ПДФ одновременно с гиперадгезивностью тромбоцитов показано при физиологическом течении беременности. С другой стороны, по данным F. Beller и соавт. (1979), при нормальном течении беременности уровень РКМФ невысок и составляет лишь 2,4% от общей концентрации фибриногена, тогда как при позднем токсикозе достигает 9,7% и включает четыре различные фракции комплексов фибрина. G. Sher, B. Statland (1985) относят определение ПДФ, а также числа тромбоцитов, фибриногена и частичного тромбопластинового времени к числу наиболее информативных тестов при синдроме ДВС в результате акушерской патологии (преждевременная отслойка нормально расположенной плаценты).
Согласно собственным данным, положительный этаноловый тест определяется у 70-80% беременных с тяжелыми формами позднего токсикоза и фактически так же часто (у 75-100%) до 4-5 сут послеродового периода. Несколько менее чувствительным является тест на фибриноген В - последний определяется лишь у 20-30% беременных с тяжелыми формами позднего токсикоза, чаще реакция оценивается от +1 до +3. В последние дни жизни больных на фоне необратимых изменений в жизненно важных органах концентрация фибриногена В, как правило, становится выше. Продукты деградации фибриногена-фибрина (ПДФ) не определяются в крови здоровых небеременных женщин, в малых количествах имеются уже в I триместре беременности, и их концентрация нарастает параллельно увеличению срока беременности (см. табл. 10). Параллельно тяжести позднего токсикоза концентрация ПДФ у беременных увеличивается, достигая 40-100 мг/мл. Высокое содержание ПДФ сохраняется при тяжелом токсикозе и в послеродовом периоде (от 15 до 200 мг/мл в 1-8-е сутки после родов).
Анализ коагулограмм у больных, погибших в результате позднего токсикоза на разные сутки послеродового (послеоперационного) периода, выявляет Определенную закономерность: нарушения гемостаза до и после родоразрешения носят различный характер, свидетельствуют о преобладании процессов внутрисосудистого тромбоза у беременных и тенденции к гипокоагуляции вплоть до тяжелых нарушений гемостаза в ряде случаев у рожениц и родильниц. Это наглядно демонстрируют тесты оценки 1-й фазы вторичного гемостаза: у беременных с тяжелыми формами позднего токсикоза укорочено по сравнению со здоровыми беременными время свертывания цельной крови (соответственно 4,1±1,2 и 6±0,1 мин), укорочено время рекальцификации. В процессе родов, оперативного родоразрешения происходит значительное удлинение как времени свертывания крови, так и времени рекальцификации, что свидетельствует о несостоятельности гемостаза в период, когда необходима его максимальная функциональная полноценность. В этот же период значительно снижается и остается низкой в 1-е сутки после родов концентрация фибриногена. Одновременно происходит удлинение времени тест-тромбина до 36-60 с (при норме 7-11 с), что является свидетельством гипофибриногенемии, резкое удлинение тромбинового времени (см. табл. 11), что также свидетельствует о гипофибриногенемии, неполноценности молекулы фибриногена, повышенном содержании повышенной активности ПДФ.
К концу 1-х суток послеродового периода концентрация фибриногена повышается до нормы, в дальнейшем при необратимом токсикозе развивается гиперфибриногенемия (в отдельных случаях до 6-9 г/л). Вместе с тем сохраняется тромбоцитопения, удлинено тромбиновое время, коагулограмма в целом свидетельствует о пролонгированном синдроме ДВС.
В процессе родов и послеродовом периоде, вплоть до гибели больных, отмечаются значительные колебания в содержании и активности факторов V, VII и VIII. Это обстоятельство, очевидно, зависит от нарушения их синтеза в печени и в меньшей степени - от процессов внутрисосудистого свертывания крови. На тяжелое поражение печени, в частности, указывает значительное снижение (до 38-60% при норме 80-100%) фактора VII (проконвертина), не потребляющегося при внутрисосудистом свертывании крови. Более значительны индивидуальные колебания в содержании в процессе родов и послеродовом периоде фактора VIII (от 40 до 86%) и фактора V (от 1-34 до 89%, в среднем 38,2%).
Изменения в системе гемостаза значительно влияют на динамику антикоагулянтной активности крови. В последние годы большое число работ посвящено содержанию при позднем токсикозе антитромбина III. Он является первичным антикоагулянтом, участвует в поддержании жидкого состояния крови, нейтрализуя коагулянты (активные факторы свертывания крови), у здоровых беременных женщин его концентрация составляет 100-140%, и среднем 112-116% (см. табл. 10).
При позднем токсикозе беременных происходит снижение уровня антитромбина III, что зависит от ряда причин: нарушения его синтеза в печени при повреждении печеночной паренхимы, потери из сосудистого русла белка с небольшой молекулярной массой (64 тыс.), истощением, потреблением в результате усиленного взаимодействия с коагулянтами в процессе пролонгированного внутрисосудистого свертывания крови. Имеется зависимость между тяжестью позднего токсикоза и содержанием антитромбина III. Нами отмечено особенно резкое снижение его в процессе беременности, осложненной поздним токсикозом (до 55-70% в тяжелых случаях). В послеродовом периоде имеются значительные колебания в содержании антитромбина III (от 47 до 150%), но в целом его концентрация выше, чем во время беременности, и средние значения соответствуют норме даже в случаях необратимого течения заболевания (см. табл. 11).
По мнению J. Berardi и соавт. (1984), у беременных с поздним токсикозом снижение антитромбина III четко коррелирует с высоким уровнем мочевой кислоты. Автор рекомендует использовать определение антитромбина III в качестве скрининга для наблюдения за развитием позднего токсикоза беременных. W. Graninger и соавт. (1985), отмечая снижение концентрации антитромбина III при тяжелом позднем токсикозе до 9,5±1,5 МЕ/мл, считают, что его в основном определяет протеинурия, так как имеется зависимость между степенью протеинурии (более 3 г/л) и низкой концентрацией антитромбина III. H. Huber, R. Brehrn (1984) считают, что снижение антитромбина III при токсикозе зависит от нарушенной функции печени и гиперкоагуляционной фазы синдрома ДВС, a G. Weenink и соавт. (1984) связывают снижение его концентрации с его усиленным потреблением в интра- и периваскулярных пространствах, и имеется зависимость между частотой инфарктов плаценты, степенью тромбоцитопении и уровнем антитромбина III. С. Weiner и соавт. (1985) расценивают активность антитромбина III, равную 70% и ниже, как показатель наличия позднего токсикоза. Отмечена зависимость между массой тела, состоянием новорожденных и активностью антитромбина III: при активности более 70% эти параметры оценки состояния детей были лучше. Эти и другие авторы отмечают, что при гипертензии и протеинурии активность антитромбина III ниже, чем при гипертензии без протеинурии.
Несмотря на большое число работ, посвященных исследованию гепарина у беременных с поздним токсикозом, в этом вопросе остается много неясного. Известно, что к концу физиологически протекающей беременности вводимый гепарин быстро нейтрализуется, толерантность к нему плазмы значительно повышена, составляет в среднем 3,3-3,5 мин но сравнению с 5,3 мин у небеременных женщин (см. табл. 10). Гепарин ингибирует активацию ряда факторов свертывания крови, в том числе тромбина, он взаимодействует с тромбоцитами, антитромбином III и др. Установлены участие систем гепаринового обмена в генезе позднего токсикоза и снижение концентрации эндогенного гепарина в III триместре параллельно увеличению тяжести осложнения [Стрижова Н. В. и др., 1985]. J. Hirsh (1984) показал, что антитромботический эффект гепарина связан главным образом с его способностью увеличивать зависящую от антитромбина III инактивацию коагулянтов, в то время как его геморрагический эффект определяется ингибицией генерации тромбина на поверхности тромбоцитов и способностью ингибировать агрегацию тромбоцитов. Представляет интерес сообщение M. Mcnabawey и соавт. (1985) о значительной и молниеносной стимуляции синтеза плацентарного протеина V введением микродоз гепарина (промывка канюль при взятии крови и др.). Плацентарный протеин V является аналогом антитромбина III и участвует в регуляции системы гемостаза у беременных женщин.
E. Gitsch и соавт. (1973) наблюдали нормализацию плацентарного кровообращения после введения гепарина беременным с поздним токсикозом, о чем свидетельствовало повышение концентрации в плазме плацентарного лактогена и эстриола. Учитывая положительный эффект гепарина на плацентарный кровоток, F. Beecham и соавт. (1974) и другие авторы применяют для лечения плацентарной недостаточности и задержки развития плода внутривенное введение 5-10 тыс. ЕД гепарина каждые 12 ч. С другой стороны, J. MacGillivray (1972) считает сомнительной вероятность растворения гепарином отложений фибрина в плаценте, допускает целесообразность его применения на ранних этапах лечения токсикоза - до появления распространенных инфарктов плаценты. По данным М. А. Репиной и соавт. (1986), подкожное или внутривенное введение 1 тыс. ЕД гепарина через каждые 4-5 ч (суточная доза 5 тыс. ЕД) в два раза снизило у беременных с тяжелыми формами позднего токсикоза частоту такого серьезного осложнения, как преждевременная отслойка нормально расположенной плаценты.
Учитывая неоднозначный ответ системы гемостаза на введение гепарина, невозможно получить верное суждение о толерантности к нему организма беременной только на основании одного-двух тестов. Необходимо выполнить параллельно несколько исследований: определение толерантности плазмы к гепарину, гепаринового времени по Сирмаи, свободного гепарина по методу Раби, индекса коагуляции.
Толерантность плазмы к гепарину, т. е. реакция плазмы на нагрузку гепарином, представляет собой хороший тест, особенно в условиях тромбоцитопении. Снижение толерантности плазмы к гепарину (8-10 мин и более) может свидетельствовать о дефиците тромбоцитов, факторов протромбинового комплекса, но повышенном содержании гепарина и антитромбина III. Повышение толерантности к гепарину (4-3 мин и менее) характерно для внутрисосудистого свертывания крови, может свидетельствовать об избытке в кровотоке тромбопластина, тромбина, связывающих гепарин, о дефиците антитромбина III. У беременных и родильниц с тяжелыми формами позднего токсикоза отмечены значительные индивидуальные колебания толерантности плазмы к гепарину (от 2 до 6 мин), однако средние параметры показателя находятся в пределах нормальных значений (см. табл. 11). В то же время значительные изменения по сравнению с физиологической беременностью получены при определении у больных поздним токсикозом гепаринового времени по методу Сирмаи. Нормальное содержание гепарина по этому методу не превышает 6-8 с (см. табл. 10). В процессе родов и в 1-е сутки послеродового периода на фоне тяжелого позднего токсикоза отмечено резкое увеличение гепаринового времени по Сирмаи (см. табл. И), что свидетельствует о значительном повышении в этот период эндогенного гепарина и, следовательно, о высокой антикоагулянтной активности крови, выраженной наклонности к кровотечению. Отмечена четкая зависимость между увеличением гепаринового времени но Сирмаи (до 53-94 с) и высокой концентрацией ПДФ в крови (100-200 мг/мл). При гепариновом времени 18-24 с концентрация ПДФ составляла 25-75 мг/мл.
Менее четкие данные получены при исследовании гепарина по Раби. Следует подчеркнуть, что гепарин является очень активным веществом, быстро вступает в контакт, связывается с другими веществами, например с антитромбином III. Поэтому любые отклонения от нормальных значений гепаринового числа по Раби (0,8-1 мкг/мл) свидетельствуют о серьезных нарушениях в системе гемостаза. У беременных с тяжелыми формами позднего токсикоза отмечается укорочение гепаринового числа по Раби до 0,5-0,7 мкг/мл, что сочетается с повышенной толерантностью плазмы к гепарину, укорочением гепаринового времени по Сирмаи. В послеродовом периоде показатели гепаринового числа по Раби неоднозначны, колеблются от 0,2 до 1 мкг/мл в 1-е сутки, 0,9-1,6 мкг/мл на 2-3-й сутки и 1,2-1,5 мкг/мл - в более поздние сроки, что в целом также свидетельствует о гипокоагуляции, усилении антикоагулянтной активности крови.
Пролонгированный синдром ДВС у беременных с тяжелыми формами позднего токсикоза вызывает значительное угнетение, истощение системы фибринолиза. Заслуживают внимания данные А. Кацулова и соавт. (1984), исследовавших выделение плазмина (фибринолизина) с мочой: у здоровых небеременных женщин активность плазмина в моче составляет 102%, у здоровых беременных достигает 140%, при легкой и средней тяжести токсикоза - 150%, а при тяжелом токсикозе снижается до 115%. Авторы справедливо считают, что повышение активности плазмина в моче свидетельствует о защитной реакции системы фибринолиза на процесс гиперкоагуляции при нетяжелых формах позднего токсикоза. Снижение активности плазмина при тяжелом токсикозе является следствием истощения фибринолитической системы, в результате доминирует коагулянтная активность, что ведет к отложению фибрина в клубочках и ухудшению функции почек. Из двух методов оценки системы фибринолиза - лизиса эуглобулинов и фибринолитической активности по методу М. А. Котовщиковой и Б. И. Кузник - более информативным представляется последний. Согласно данным этого метода, имеется резкое угнетение фибринолитической активности крови у беременных с тяжелыми формами позднего токсикоза: 2,9±0,7% при 6,7±0,4% у здоровых беременных, индивидуальные колебания 1-5%. Истощение системы фибринолиза наблюдается в течение всего послеродового периода, вплоть до гибели больных (см. табл. 11). Парадоксальной реакцией следует считать короткий период выраженной активации фибринолиза в процессе родов, оперативных родоразрешающих вмешательств. Это обстоятельство одновременно со снижением толерантности плазмы к гепарину у рожениц с тяжелыми формами позднего токсикоза свидетельствует о серьезном дефиците гемостаза в наиболее напряженный период повышенных к нему требований организма. Биохимические гемостазиограммы при токсикозе хорошо дополняют электрофизиологические методы исследования гемостаза - тромбоэластограммы, коагулограммы.
Электрокоагулографическая характеристика гемостаза включает следующие параметры: T1 - начало свертывания крови, определяют путем подсчета импульсов на диаграммной ленте от начала записи до первого импульса с уменьшенной амплитудой (рис. 13). Одно деление на бумаге соответствует 1 мин, один импульс - 10 с; норма 2,5±0,18 мин; Т2 - конец свертывания крови, определяют от начала записи до первого импульса с минимальной амплитудой, норма 9,1±1 мин; Трф - время наступления ретракции и фибринолиза, определяют от начала записи до первого импульса с увеличенной амплитудой после минимальной, норма 9,2±1,5 мин; Ам - максимальная величина амплитуды в начале записи, отражает состояние глобулярного объема, норма 0,5±0,1 ед. По данным Л. Ф. Коблова (1979), существует следующая зависимость между величиной Ам и показателем гематокрита: при Ам 90 мм и более Ht равен 0,15-0,1 л/л; при Ам 80 мм - 0,25 л/л; при Ам 60 мм - 0,4 л/л; при Ам 40 мм - 0,45 л/л; при Ам 24 мм - 0,5 л/л; при Ам 20 мм - 0,7 л/л. А0 - определяют по величине минимальной амплитуды. Отражает уровень фибриногена в крови, норма 0,4±0,1 ед. Арф - амплитуда ретракции и фибринолиза. Определяют через 10 мин после минимальной амплитуды по величине амплитуды, норма 0,82±0,18% (см. рис. 13). По данным Е. П. Иванова (1983), при экспресс-диагностике нарушений гемостаза особое значение имеют показатели Ам, А0, Арф, Т2, Трф. У беременных с поздним токсикозом, сопровождающимся фазой гиперкоагуляции синдрома ДВС и торможением фибринолиза, происходит укорочение T1 и Т2, увеличена Ам, может отсутствовать Трф (рис. 14).
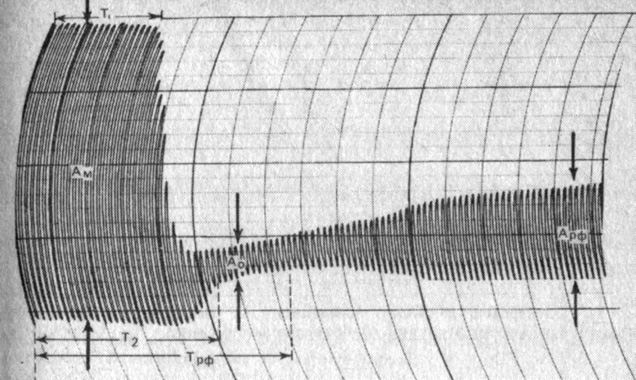
Рис. 13. Параметры электрокоагулограммы. Объяснение в тексте
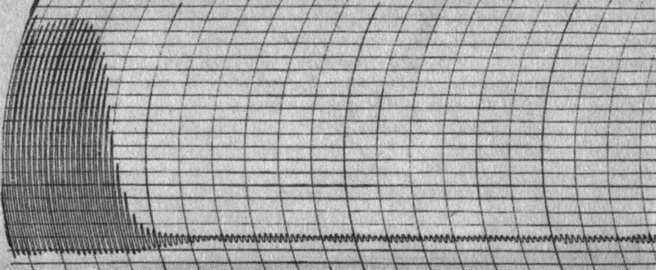
Рис. 14. Электрокоагулограмма беременной А. Беременность 39/40 нед. Преэклампсия. Гиперкоагуляция. Фибринолиз заторможен
В случаях выраженной гипокоагуляции, нарушения функции тромбоцитов и снижения ретракции кровяного сгустка электрокоагулограмма приобретает двухступенчатый вид, Т1, Т2, Трф резко удлинены, Арф увеличена (рис. 15).
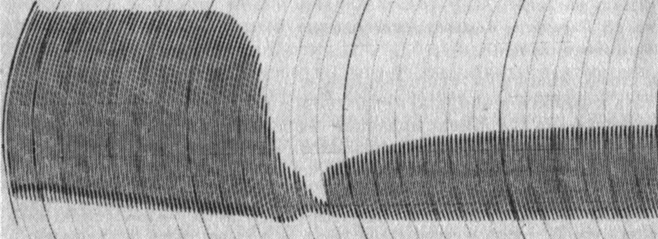
Рис. 15. Электрокоагулограмма беременной М. Беременность 36/37 нед. Болезнь Виллебрандта. Отеки беременных. Гипокоагуляция. Снижение ретракции кровяного сгустка
При высокой активации фибринолиза электрокоагулограмма представляет собой сплошной массив, все колебания которого фактически остаются на уровне максимальной амплитуды, с очень небольшим снижением. Имеет место резкое увеличение А0, Арф (рис, 16).
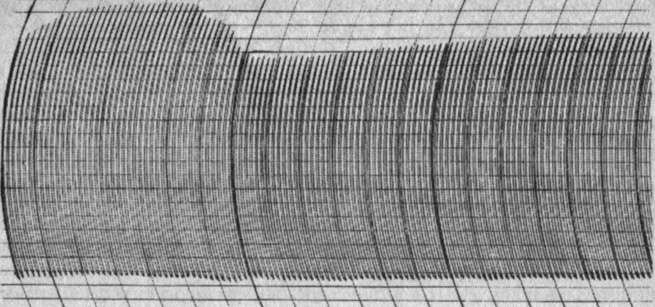
Рис. 16. Электрокоагулограмма беременной О. Беременность 35/36 нед. Варикозная болезнь. Нетяжелая форма позднего токсикоза
В случаях гипокоагуляции на фоне преждевременной отслойки нормально расположенной плаценты характер электрокоагулограммы меняется, что зависит от степени нарушений в системе гемостаза, состояния системы фибринолиза (рис. 17).
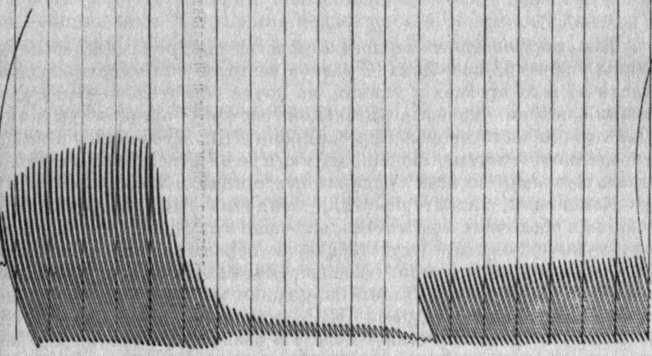
Рис. 17. Электрокоагулограмма беременной О. Преждевременные роды 34/35 нед. Преэклампсия. Преждевременная отслойка нормально расположенной плаценты. Гипокоагуляция. Умеренная активация фибринолиза
Таким образом, изменения в системе гемостаза при позднем токсикозе беременных неоднозначны, свидетельствуют как о процессах внутрисосудистого тромбоза, так и о дефиците факторов гемостаза, что в процессе беременности можно обычно характеризовать как I-II, иногда III (преждевременная отслойка нормально расположенной плаценты) стадии синдрома ДВС. Напряженность, разрегулированность гемостаза, с одной стороны, часто проявляется его неадекватностью в процессе родоразрешения этих больных, создает высокий риск кровотечения в родах и при оперативных вмешательствах, с другой - приводит к необратимым изменениям в жизненно важных органах.
Так, морфологические доказательства синдрома ДВС обнаружены у 36 из 53 погибших. С разной частотой они имелись фактически во всех органах и тканях, но почти обязательно в мозговой ткани, печени, мочевыделительной системе, органах дыхания. Достаточно часто проявления синдрома ДВС встречались в пищеварительной системе, сердце, матке, в клетчатке, мышцах, коже, присутствовали во всех эндокринных органах (табл. 12).
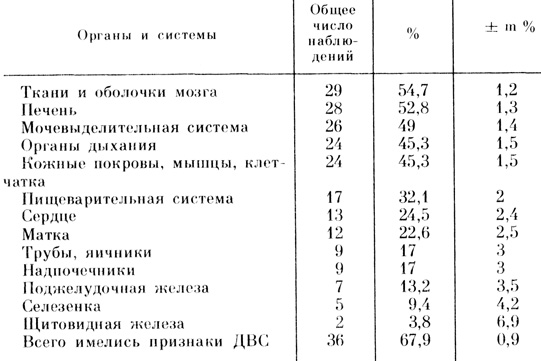
Таблица 12. Частота морфологических признаков синдрома ДВС у погибших в результате позднего токсикоза (n=53)
Изменения, характерные для синдрома ДВС, встречались в тканях и оболочках мозга несколько чаще в случаях, где при жизни приступы эклампсии отсутствовали и поражение мозга проявлялось нарастающей комой. Характер морфологических изменений при этом выявлял все стадии нарушения мозгового кровообращения в результате синдрома ДВС - от полнокровия сосудов до массивного кровоизлияния в мозг. На разных препаратах и в разных сочетаниях находили следующие изменения: полнокровие и неравномерное полнокровие сосудов мозга и мозговых оболочек, особенно мягких, иногда распространенный, иногда умеренный тромбоз мелких сосудов, иногда их дилатацию, чередование тромбоза с заполнением сосудов жидкой, иногда гемолизированной, кровью. Характерны периваскулярные кровоизлияния, муфтообразные скопления эритроцитов вокруг мозговых сосудов. Экстравазаты распространенного характера определялись как в ткани, так и в оболочках мозга, сочетались с периваскулярными некрозами. В ткани мозга - чаще белом, реже сером веществе - имелись множественные, иногда единичные, кровоизлияния - мелкоточечные или более крупные, в виде больших темно-красных образований, вплоть до массивного кровоизлияния. Реже, чем в белом веществе, мелкоточечные кровоизлияния встречались в других образованиях мозга - зрительном бугре, мосту мозга, стволовой части, мозжечке. Нередко они сочетались с множественными некрозами, что свидетельствовало о давности сосудистых нарушений в ЦНС. Кровоизлияния от мелких единичных до множественных очаговых захватывали субарахноидальное пространство, мягкие оболочки головного мозга, иногда оболочки спинного мозга. Наблюдались кровоизлияния в гипофиз - его переднюю долю, где они выглядели в виде мелкоточечных, диаметром до 0,1 см, образований на фоне полнокровия сосудов и стаза. Следует подчеркнуть, что кровоизлияния чаще локализовались в левом полушарии мозга.
Представленные данные фактически расшифровывают все стадии развития необратимых изменений в ЦНС, в основе которых лежат патологические изменения в сосудистой системе мозга: нарушения периферического кровотока со стазом эритроцитов, их лизисом, развитием микросвертков (рассеянные тромбы), нарушением структуры сосудистой стенки с выходом эритроцитов, плазмы в окружающую ткань (экстравазация) и формированием микрокровоизлияний, иногда сливающихся в довольно большие образования. Нарушения периферического кровообращения с синдромом ДВС, изменениями эндотелия в сочетании с внутричерепной гипертензией лежат в основе массивных кровоизлияний в мозг при токсикозе.
Разнообразны проявления синдрома ДВС в печени. Их характер подтверждает ту же стадийность морфологических изменений, в основе которых лежит длительное нарушение печеночного кровообращения с непременным его спутником - синдромом ДВС: застойное полнокровие со скоплением в части сосудов гемолизированной крови, что сочетается с кровоизлияниями от мелких, точечных, иногда очаговых, до крупных, обширных, сливающихся между собой и занимающих значительную часть ткани печени. Количество кровоизлияний колеблется от единичных, немногочисленных, до множественных. Они практически всегда сопровождаются образованием в печени участков некрозов - от очаговых (редко) до множественных, обширных, занимающих почти всю паренхиму печени. В участках некроза определяются скопления фибрина, иногда вокруг некротизированных участков наблюдается реактивная пролиферация.
Различной величины кровоизлияния - от петехиальных, немногочисленных или множественных до очаговых, пятнистых и, наконец, обширных, сливающихся между собой, - располагаются под капсулой печени - но передней, задней и диафрагмальной поверхностям. Иногда формируются значительные субкапсулярные гематомы.
Обширные и распространенные изменения характерны для проявлений синдрома ДВС в мочевыделительной системе. В сосудах почек наблюдается разнообразная, пестрая картина в виде полнокровия, застойного, неравномерного полнокровия, гемолиза, тромбоза. Этим изменениям сопутствует отек слизистых оболочек чашечек, лоханок и мочеточников. Кровоизлияния от точечных, мелких, до мелкопятнистых, очаговых, но не таких обширных, как в мозговой ткани и печени, локализуются под слизистой оболочкой лоханок, мочеточников, под капсулой почек, иногда в паренхиме - корковом и мозговом слое, сочетаются с участками некроза.
Наблюдается резкий отек мочевого пузыря, что гистологически подтверждается отечным разрыхлением ткани. На этом фоне формируются множественные, реже единичные мелкоточечные, пятнистые, очаговые (до 0,5-1 см в диаметре) кровоизлияния под слизистую или захватывающие всю толщу стенки мочевого пузыря. Локализация кровоизлияний разная, но чаще по задней стенке, особенно в области устьев мочеточников, реже - в области дна.
Изменения в органах дыхания в целом повторяют описанные выше: резко выраженное нарушение кровообращения в сосудистой системе легких, в просвете мелких ветвей легочной артерии, артериол и капилляров определяются распространенный тромбоз, полнокровие, в отдельных сосудах - лейкостазы и др. Выражен интерстициальный и внутриальвеолярный отек. Кровоизлияния в альвеолы и межуточную ткань макроскопически представлены в виде образований разных размеров, часто пятнистой формы, особенно многочисленных по задней поверхности легких, которые в результате имеют мраморный темно-красный вид.
Множественные точечные и мелкие кровоизлияния располагаются в висцеральной и париетальной плевре, на голосовых связках и слизистых оболочках гортани и бронхов. Слизистая часто отечна, синюшна, сосуды крупных и мелких бронхов, трахеи содержат фибриновые тромбы, жидкую кровь.
Для тяжелых форм позднего токсикоза беременных очень характерны признаки ДВС в пищеварительной системе. Они встретились в трети всех случаев (см. табл. 12). Следует отметить, что в 11 из 17 случаев было обильное маточное кровотечение в результате преждевременной отслойки нормально расположенной плаценты или гипотонии матки в сочетании с коагулопатией. Множественные мелкие кровоизлияния наблюдаются в слизистой пищевода, очаговые кровоизлияния - в окружающей его клетчатке, множественные мелкие и сливающиеся, пятнистые определяются в переднем и заднем средостении, диафрагме. Всегда наиболее значительны и выражены изменения в желудке. Они представлены множественными и более редкими мелкоточечными, мелкопятнистыми, очаговыми и единичными обширными (до 5-7 см в диаметре) кровоизлияниями в слизистую оболочку желудка, под его серозный покров. В отдельных случаях на слизистой оболочке желудка определяют острые кровоточащие эрозии и трещины. Рассеянные в мелкоточечные кровоизлияния разбросаны под слизистой оболочкой двенадцатиперстной, тонкой (чаще) и толстой кишки, в брыжейке кишки, в разных отделах серозного покрова брюшной полости.
Изменения в сердце, свидетельствующие о синдроме ДВС, менее разнообразны. Отмечаются отек межмышечной ткани, неравномерное полнокровие, гемолиз в сосудах миокарда, множественные и одиночные, крупные и мелкопятнистые кровоизлияния в толщу миокарда, располагающиеся, как правило, в области задней стенки левого желудочка. С одинаковой частотой встречаются кровоизлияния под эндокард - от множественных, небольших, до крупных, единичных, которые локализуются в области левого желудочка или межмышечной перегородки со стороны левого желудочка, а также кровоизлияния под эндокард - очаговые, мелкие и точечные, множественные, свежие.
Следует подчеркнуть, что указанные изменения чаще развивались на фоне позднего токсикоза, осложненного большой кровопотерей.
Всегда значительными были изменения в матке. Они выражались в отеке межуточной ткани, дискомплексации мышечных волокон, резком расстройстве кровообращения в виде полнокровия, иногда неравномерного, стазов, тромбозов, наличия гемолизированной крови в сосудах. Обычно множественными от мелких (реже) до обширных массивных были кровоизлияния в миометрий, иногда достигавшие серозного покрова матки. Их локализация также была разнообразной, но более выражены кровоизлияния были в области, примыкающей к плацентарной площадке, в области дна, задней стенки матки.
Полнокровие капилляров, их дилатация отмечались в трубах, яичниках. Кровоизлияния под капсулу яичников и в их строму были, как правило, множественными, свежими, иногда достаточно обширными. Трубы - отечны, цианотичны, с очаговыми кровоизлияниями под слизистую оболочку, в толщу стенки, иногда с развитием гематосальпингса. Подобные же изменения определяли во влагалище, в связочном аппарате матки, где кровоизлияния были довольно обширными, иногда с образованием гематом широких маточных связок. Очаговые и обширные кровоизлияния определяли в клетчатке малого таза - параметральной, околопузырной и др.
Из органов внутренней секреции особенно значительными были изменения в надпочечниках - в виде выраженного расстройства кровообращения, полнокровия сосудов, тромбозов, стазов, мелких кровоизлияний, чаще в мозговом слое, нередко сочетающихся с очагами некроза и, наконец, обширных двусторонних гематом надпочечников, когда кровоизлияние захватывало корковый и мозговой слой настолько, что их ткань не определялась или мозговое вещество имело вид расползавшейся жидкой кровянистой массы. Кровоизлияния в ткань надпочечников сочетались с обширными или мелкими зонами некрозов, дискомплексацией секреторных клеток, резко выраженными их дистрофическими изменениями, аутолизом клеток мозгового и обеднением липидами клеток коркового слоев.
Аналогичные изменения: полнокровие и неравномерное полнокровие сосудов, мелкие отдельные и множественные или множественные пятнистые, достаточно крупные кровоизлияния в межуточную ткань, под капсулу, в сочетании с очагами некрозов, придающие органу пестрый вид, - отмечены в поджелудочной железе. Им сопутствовало отечное разрыхление межуточной ткани и окружающей клетчатки. Поджелудочная железа была дряблой, чаще синюшно-серого цвета, на разрезе беловатая, бледная, малокровная. В сосудах щитовидной железы было выражено полнокровие, неравномерное полнокровие. Синусы селезенки расширены, переполнены кровью, пульпа гиперплазирована, сочная, в сосудах гемолизированная кровь, очаговые кровоизлияния и множественные некрозы органа, ткань дряблая, с поверхности синюшная, на разрезе полнокровная.
Достаточно большие по размерам кровоизлияния имелись на многих участках кожной поверхности, особенно в местах инъекций, секций, в области операционной раны: обширные кровоизлияния вплоть до значительных по объему гематом передней брюшной стенки с захватом подкожной клетчатки, мышц, париетальной брюшины. У 13 погибших эти изменения были в основном связаны с патологической кровопотерей в родах и сочетались с признаками незамещенной кровопотери - бледностью кожных покровов, слабой выраженностью трупных гипостазов, анемией миокарда, печени, почек и других органов.
Синдрому ДВС при позднем токсикозе беременных сопутствует микроангиопатическая гемолитическая анемия [Pritchard J. et a]., 1954]. Она характеризуется образованием фибриновых свертков в микрососудах, увеличением концентрации ПДФ, гемолизом с увеличением концентрации свободного гемоглобина в плазме, появлением аномальных форм эритроцитов [Brain M. et al., 1967]. По данным Н. В. Анастасьевой и соавт. (1985), при тяжелом токсикозе появляются мишеневидные, сигаровидные эритроциты, наблюдаются микроцитоз, анизо-, пойкилоцитоз, наличие фрагментов эритроцитов. Микроангиопатическая гемолитическая анемия может иногда проявиться как самостоятельный синдром, что сопровождается тяжелым поражением почек у беременных женщин [Kwaan Н., 1985]. Н. Graeff и соавт. (1984) наиболее характерной локализацией отложений фибрина в этих случаях считают почечные клубочки, маточно-плацентарный кровоток. Причины микроангиопатической гемолитической анемии при синдроме ДВС на фоне позднего токсикоза интенсивно изучают в последние годы. Отмечено значение механического повреждения эритроцитов нитями фибрина, а также тяжелых нарушений эритроцитарной мембраны, трофики клеток и др. Исследования Н. В. Анастасьевой и соавт. (1985) показали достоверное снижение гемолитической стойкости эритроцитов у матерей и новорожденных с укорочением времени общего гемолиза всей популяции клеток с 6,5±0,5 мин при нетяжелом токсикозе до 2,5 + 1 мин при эклампсии. Параллельно нарастанию тяжести позднего токсикоза увеличивалась концентрация свободного гемоглобина. Л. Е. Туманова и соавт. (1986) выявили у беременных с поздним токсикозом повышение содержания 2,3-дифосфоглицерата, которое происходит параллельно нарастанию тяжести заболевания и нарушает кислородсвязывающую способность эритроцитов. Р. И. Шалина и соавт. (1986) показали увеличение микровязкости мембран эритроцитов и снижение параметра гидрофобности, что, очевидно, связано с повышением при токсикозе перекисного окисления липидов, а Л. Г. Сотникова и соавт. (1986) обнаружили нарушение липидной пероксидации эритроцитарных мембран со снижением стойкости эритроцитов к перекисному гемолизу при нарастании тяжести токсикоза и гипотрофии плода.
Следует подчеркнуть известный факт, что в процессе беременности, осложненной поздним токсикозом, нарушения гемостаза в основном проявляются недостаточностью жизненно важных органов и систем: ОПН, острой печеночной недостаточностью, нарушением мозгового кровообращения, плацентарной недостаточностью, иногда - геморрагическим синдромом (преждевременная отслойка нормально расположенной плаценты, кровоизлияние в мозг, субкапсулярные гематомы печени с их разрывом). В то же время ситуация меняется в процессе родов и послеродовом периоде, когда к симптомам недостаточности тех или иных органов и систем присоединяется геморрагический диатез - или умеренно выраженный, или тяжелый, вплоть до неконтролируемого. В процессе родов (послеродовой, ранний послеродовой период), при операции кесарева сечения он в большой степени проявляется клиникой маточного кровотечения, спустя несколько часов, суток после родов - кровотечением, вплоть до обильного, из других органов. Чаще начало геморрагических проявлений относится к 1-м суткам послеродового периода, но нередко геморрагический диатез развивается и в более поздние сроки (на 2-6-е сутки после родов). Геморрагический диатез в послеродовом периоде развился у 20 больных. Наиболее часто отмечены желудочные кровотечения, что выражается как рвотой массами цвета "кофейной гущи", появлением геморрагического отделяемого по желудочному зонду, так и рвотой алой кровью и профузным желудочным кровотечением в течение ряда часов, с усилением к терминальному периоду. Так же часто наблюдается гематурия. Нередки проявления синдрома ДВС в виде длительных (до 2 сут и более) кровотечений, вплоть до значительных, из полости рта, десен, из носовых ходов. Так, носовое кровотечение потребовало длительной передней и задней тампонады у двух больных. Наблюдаются случаи кровотечения из дыхательных путей как в виде отделяемого геморрагического характера, так и значительного, в течение ряда суток, с последующим удалением свертков крови длиной до 7 см из средних бронхов (у больной, родоразрешенной операцией кесарева сечения в связи с эклампсией в 34/35 нед беременности). В данном случае геморрагический диатез развился на 6-е сутки после родоразрешения. Кровотечение из дыхательных путей сочеталось с желудочным кровотечением, гематурией, геморрагические проявления наблюдались в течение 4-5 сут, сопровождались тяжелой анемией, несмотря на заместительную и гемостатическую терапию. По данным коагулограммы отмечались тромбоцитопения до 90·109/л, появление ПДФ, фибриногена Б с одновременным резким угнетением фибринолитической активности крови. Гипокоагуляция регистрировалась на ТЭГ.
Клиническими проявлениями геморрагического диатеза у больных также являются петехиальные высыпания на коже лица, шеи, груди, брюшной стенки, конечностей, появление обширных и более мелких гематом в местах инъекций, повышенная кровоточивость при секции вен, повторных оперативных вмешательствах. Подобная клиническая картина сопровождается мраморностью кожных покровов с выраженным рисунком подкожных вен, резкой бледностью, периферическим цианозом и др.
|
ПОИСК:
|
Саенко Инна Александровна, автор статей
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://m-sestra.ru/ 'M-Sestra.ru: Сестринское дело'