
БИБЛИОТЕКА
МАНИПУЛЯЦИИ
ЗАБОЛЕВАНИЯ
БАЗОВЫЕ ВОПРОСЫ
КУРОРТОЛОГИЯ
ССЫЛКИ
О САЙТЕ
Ошибки в лечении
Лечение позднего токсикоза беременных целесообразно рассматривать с учетом следующих моментов:
1. Патогенетическим в полном смысле слова является только лечение прерыванием беременности. Используя те или иные препараты, можно добиться ремиссии заболевания, что выражается в снижении уровня артериальной гипертензии или даже нормализации АД, улучшении функции почек с увеличением суточного объема мочи, полным или почти полным прекращением протеинурии, уменьшении отеков. Однако определенная часть больных остается резистентной к любому "набору" лекарственных средств, тяжесть токсикоза у них прогрессирует, несмотря на проводимую терапию. Эти больные составляют группу высокого риска острого и быстрого развития функциональной недостаточности витальных органов в виде клиники эклампсии, комы, ОПН, ОДН и др. Поэтому, приступая к лечению беременных с поздним токсикозом, всегда нужно иметь в виду этот аспект, вовремя его учесть, изменить тактику консервативного ведения и продолжения беременности.
2. Безусловно, что лечение каждой беременной женщины с поздним токсикозом должно быть строго индивидуальным, учитывать сопутствующую акушерскую патологию, возраст и другие моменты. Вместе с тем практическому врачу иногда бывает сложно разобраться в большом числе поступающих в лечебную сеть различных препаратов и в большом числе тех или иных рекомендаций их применения. Поэтому, вероятно, в определенной степени лечение позднего токсикоза должно быть стандартизовано, обеспечено конкретными рекомендациями по препаратам, их дозам, показаниям к введению, срокам применения, дальнейшей тактике с учетом эффективности лечения, динамики заболевания и др. Примером таких стандартизованных методов лечения являются у нас в стране методы Строганова, Бровкина, применение которых спасло большое число больных, за рубежом - метод Pritchard.
Стандартизация подходов к лечению должна предусматривать и время его проведения, так как на успех, эффективность, помимо прочих факторов, влияет своевременность начала терапевтических мероприятий. Можно полагать, что лечение позднего токсикоза должно начинаться также срочно, неотложно, как и лечение акушерских кровотечений или акушерского сепсиса. Понятие своевременности начала лечения имеет разное значение в начале заболевания, при его легком течении, когда оно определяется днями, при прогрессировании осложнения, тяжелом течении, когда оно определяется часами, реже 2-3 днями, при крайней тяжести, когда оно определяется минутами.
3. Лечение больных поздним токсикозом представляет собой очень сложную задачу, которую не решает назначение медикаментозных препаратов, начиная от магния сульфата и кончая новейшими средствами нейроплегического, гипотензивного, наркотического и другого действия. Напротив, избыточные объемы лечения представляют значительную опасность для больной, и сверхмассивное лечение само по себе может явиться причиной смертельного исхода, так как выведение организма из терминального состояния в случаях глубоких нарушений гомеостаза, медикаментозной депрессии функции миокарда, внешнего дыхания и др. - вопрос очень сложный, часто неразрешимый. Очевидно, что легче с помощью подобного лечения разрегулировать все функции, чем затем их восстановить.
Указанные соображения не новы, хорошо известны, обсуждаются в специальной литературе и влияют на отношение к тем или иным методам на разных исторических этапах лечения позднего токсикоза (широкое назначение диуретических препаратов, затем отказ от них, применение больших объемов инфузий, затем их резкое ограничение; использование гипер- или изотонических растворов и др.).
Лечение позднего токсикоза невозможно без применения гипотензивных препаратов. В последние годы отношение к ним стало более осторожным, так как наблюдается выраженный их взаимно потенцирующий эффект; гипотензивным действием обладают также многие наркотические, седативные средства, нейролептики и транквилизаторы, что, во-первых, может привести к развитию неуправляемой гипотензии, а во-вторых, способствовать ухудшению маточно-плацентарного кровотока и тем самым приводить к еще большему нарушению жизнедеятельности плода при токсикозе.
Выделяют 4 группы гипотензивных препаратов, среди которых наиболее "старую" составляют седативные препараты центрального действия: трава пустырника, валериана, препараты брома и магния сульфат. За последним препаратом более полувека сохраняется ведущая роль в лечении тяжелых форм позднего токсикоза. Примененный впервые в 1907 г., он затем стал широко использоваться как в нашей стране, так и за рубежом. Были разработаны разные методы применения магния сульфата; его вводили в спинномозговой канал, внутривенно, подкожно в виде 3% раствора по 200 мл (6 г сухого вещества) 2-4 раза в сутки, затем в виде 20% раствора по 30 мл и в других концентрациях в сочетании с глюкозой и аскорбиновой кислотой и, наконец, в виде 25% раствора по 24 мл (суточная доза в пересчете на сухое вещество - 24 г) с повторением через 12 ч [Бровкин Д. П., 1953]. Эта методика широко используется в нашей стране и в настоящее время, являясь высокоэффективной.
За рубежом применяют метод J. Pritchard, S. Pritchard (1975), J. Pritchard (1979), согласно которому первую дозу магния сульфата (4 г сухого вещества) вводят внутривенно со скоростью 1 г/мин в виде 20 мл 20% раствора. Ее дополняют одновременным внутримышечным введением 50% раствора по 10 мл в каждую ягодицу (всего в пересчете на сухое вещество 10 г). Последующие поддерживающие дозы составляют в пересчете на сухое вещество 5 г при внутримышечном введении каждые 4 ч. Отсутствует строго определенная максимальная суточная доза, так как каждая следующая инъекция в пересчете на сухое вещество 4 г магния сульфата зависит от состояния рефлексов (продолжают при гиперрефлексии, о чем судят по характеру коленного рефлекса), состояния дыхания (при учащении дыхания дальнейшее введение препарата прекращают) и объема мочи, который за время от последней инъекции (4 г магния сульфата в пересчете на сухое вещество) должен быть не менее 100 мл.
Следует отметить, что отсутствие в данном методе максимальной суточной дозы препарата и значительная первоначальная доза (14 г сухого вещества магния сульфата) могут способствовать остановке дыхания со смертельным исходом (наблюдали J. Pritchard и соавт., 1984). Те Lin Liu (1982) рекомендует начинать введение магния сульфата по методу Pritchard, в дальнейшем поддерживающие дозы обеспечивать за счет постоянного внутривенного введения препарата со скоростью 1-2 г/ч до общей суточной дозы 30 г сухого вещества. W. Lobbe (1984) первоначальную дозу сухого вещества (4 г) рекомендует вводить внутривенно в виде 8 мл 50% раствора в растворе глюкозы со скоростью 1 г/ч. Поддерживающая доза зависит от массы тела. S. Rolbin и соавт. (1981), указывая на целесообразность контроля за введением магния сульфата по состоянию рефлексов (гиперрефлексия предвещает приступ эклампсии), в то же время отмечают, что эпидуральная анестезия, одновременное применение других седативных и наркотических препаратов могут влиять на коленный рефлекс, а интоксикация магнием способствует мышечной слабости, совместно с другими седативными средствами уменьшает адекватность дыхания.
Механизм действия магния сульфата многообразен, что важно у больных поздним токсикозом: оказывает седативное действие, а при введении очень больших доз (что опасно из-за возможной остановки дыхания) может вызвать наркотический эффект. Обладает курареподобным действием, так как угнетает передачу нервно-мышечного возбуждения, вызывает нейромышечную блокаду. На этом свойстве магния сульфата основан его противосудорожный эффект. Препарат снимает спазм артериол, о чем свидетельствует снижение систолического АД (на 4,4%), диастолического АД (на 10,5%), снижение периферического сосудистого сопротивления (на 27,7%), увеличение минутного объема сердца (на 18,3%), появляется тенденция к уменьшению частоты сердечных сокращений [Schwarz R. et al., 1979]. M. Lee и соавт. (1984) показали, что гипотензивное действие магния сульфата связано с торможением ответа сосудов на прессорные субстанции (норадреналин). В процессе выделения почками увеличивает диурез, в терапевтических дозах не оказывает отрицательного влияния на плод. J. Pritchard (1979) считает, что первым признаком интоксикации при введении магния сульфата является снижение (утрата) коленного рефлекса, затем нарушение дыхания, паралич дыхательной мускулатуры, что может привести к гипоксии плода. Токсическое действие препарата на плод может проявиться угнетением дыхания, нарушением сердцебиения и снижением рефлексов у новорожденного. При длительной передозировке препарата возможны гипокальциемия и связанная с нею тетания, поражение клубочков с развитием олигурии.
Поэтому имеет значение определение концентрации ионов магния у беременных с поздним токсикозом. В норме концентрация Mg2+ в сыворотке крови составляет 0,75-1 ммоль/л. По данным Г. М. Савельевой и соавт. (1977), концентрация ионов Mg у беременных с тяжелой нефропатией равна 1,2±0,03 мэкв/л (0,6 ммоль/л), при эклампсии и преэклампсии - 0,92±0,02 мэкв/л (0,46 ммоль/л) по сравнению с 1,82±0,06 мэкв/л (0,9 ммоль/л) у здоровых беременных женщин. Л. А. Кондратьевой (1984) были определены концентрации ионов магния у небеременных и здоровых беременных женщин соответственно 1,12 и 0,93 ммоль/л. При отеке и легких формах позднего токсикоза концентрация ионов магния составляла 0,93-0,77 ммоль/л, при тяжелой нефропатии - 0,69 ммоль/л. При назначении салуретиков экскреция ионов магния резко увеличивается, что требует замещения его потерь. При этом автором не отмечено значительного повышения ионов кальция в сыворотке крови, концентрация которого у здоровых небеременных, здоровых беременных, беременных с нетяжелым и тяжелым токсикозом соответственно равнялась 2,5; 2,32; 2,24 и 2,15 ммоль/л. Известно, что при физиологическом течении беременности концентрация Mg2+ остается в пределах нормальных значений, а концентрация Ca2+ снижается. В случаях гипотрофии плода (без осложнения беременности поздним токсикозом) концентрация Mg2+ увеличивается параллельно увеличению срока беременности, в то время как концентрация Ca2+ уменьшается. Снижение концентрации ионов магния у здоровых беременных женщин (0,72±0,07 ммоль/л) по сравнению с небеременными (0,83±0,06 ммоль/л) обнаружили Н. Wilson и соавт. (1985). При позднем токсикозе концентрация ионов магния была аналогична таковой у здоровых небеременных женщин. Авторы считают, что обмен магния у беременных определяют особенности диеты, функция пищеварительной системы, почек. Имеет значение синтез паращитовидными железами паратгормона и кальцитонина, регулирующих гомеостаз кальция и магния.
Введение магния сульфата существенно меняет концентрацию Mg в плазме: по данным D. Gruikshank и соавт. (1979), введение 4 г препарата повышает содержание Mg2+ на 150%, или до 3,3-4,4 мэкв/л (1,65-2,2 ммоль/л). Уровень ионизированного Ca2+ при этом снижается на 16% (до 1,89 мэкв/л). Одновременно возрастает концентрация паратгормона, не меняется концентрация кальцитонина, что обеспечивает гомеостаз кальция. В. Sibai и соавт. (1984) определяли концентрацию Mg2+ в сыворотке крови при двух методах введения магния сульфата: 1) при внутримышечном по методу Pritchard и 2) при пролонгированном внутривенном введении поддерживающих доз 1-2 г/ч. Более высокая концентрация Mg2+ в сыворотке крови обнаружена при внутримышечном введении препарата, достаточно высокая - при внутривенном введении препарата в дозе 2 г/ч. Доза 1 г/ч магния сульфата не обеспечивала повышения содержания Mg2+ в крови, поэтому признана авторами неадекватной для лечения токсикоза. Любые методы введения магния сульфата не влияли существенно на ЭЭГ, которые оставались аномальными у большинства больных и не зависели от уровня ионов магния в крови. W. Lobbe (1984) считает, что определять Mg2+ в сыворотке крови беременных при лечении позднего токсикоза следует каждые 2 ч: терапевтическое действие достигается при введении 6-8 ммоль/ч ионизированного магния, коленный рефлекс исчезает при введении 10 ммоль/ч, остановка дыхания происходит при введении 12-15 ммоль/ч.
Имеются отдельные возражения относительно широкого применения магния сульфата у беременных с поздним токсикозом: препарат оказывает токолитическое действие на миометрий, в связи с чем возможны нежелательное пролонгирование беременности, отсутствие эффекта от родовозбуждения, слабость родовой деятельности, кровотечения в последовом и раннем послеродовом периодах. Отмечены его плохая переносимость некоторыми больными, не всегда достаточно выраженное гипотензивное действие, непродолжительный положительный эффект на гемодинамические показатели. Так, по данным D. Cotton и соавт. (1984), при внутривенной инфузии 1,5 г/ч магния сульфата увеличивается сердечный выброс, снижается среднее АД, сопротивление в легочной артерии и общее периферическое сосудистое сопротивление. Однако через 30 мин после прекращения инфузии почти все показатели возвращаются к исходному уровню. R. Knuppel, R. Montenegro (1983), О. Fettig (1983) и др. считают, что магния сульфат является препаратом выбора как антиконвульсивное средство, обеспечивающее профилактику эклампсии, в однократной дозе 4-5 г внутривенно с помощью поддерживающих доз. В то же время введение препарата не снижает АД. Для достижения гипотензивного эффекта указанные авторы, а также А. Кацулов и соавт. (1985), A. Conradt (1985) и др. используют обязательное сочетание магния сульфата с гипотензивными средствами, в основном периферическими вазодилататорами (непресол, депрессан, гидралазин и др.).
A. Conradt (1984, 1985) придает дефициту магния основное значение в развитии судорожной готовности и приступов эклампсии: Mg2+ участвует во всех процессах гомеостаза - регуляции углеводного, белкового обмена, активации ферментов, транспорте калия и натрия, регуляции гемостаза (подавляет агглютинацию тромбоцитов, стабилизирует фибриновый сгусток, активирует фибринолиз). Поэтому дефицит магния может привести к развитию гестоза: в силу антагонизма кальция и магния уменьшение концентрации последнего способствует повышению содержания Ca2+ в клетках, нарушению микрокровотока, гиперкоагуляции и отложению микросвертков в сосудах. Дефициту магния могут способствовать преобладание в питании продуктов с преимущественным содержанием белков и жиров, алкоголь, стрессовые ситуации, прием диуретиков. Потребность в магнии выше у беременных женщин, больных диабетом. A. Conradt (1985) считает, что раннее и длительное введение препаратов магния может предотвратить развитие преэклампсии - применение препаратов магния в качестве токолитика при угрожающем прерывании беременности и другой акушерской патологии способствовало профилактике артериальной гипертензии у беременных. Отмечена также четкая корреляция между частотой гипотрофии плода и количеством введенного за беременность магния сульфата: чем больше общая доза, тем реже рождались дети с гипотрофией. Поэтому суточная доза магния сульфата при лечении позднего токсикоза составляет 24-72 г, что зависит от суточного объема мочи. A. Conradt (1985) признает стремление использовать в случаях позднего токсикоза другие антагонисты кальция, но так как физиологическим его антагонистом является магний, то основным компонентом лечения должна оставаться магнезиальная терапия.
Тем не менее в последние годы получила довольно широкое применение терапия тяжелых форм позднего токсикоза с использованием других препаратов - антагонистов кальция; применяют коринфар (нифедипин), изоптин (верапамил) и др. [Rasmussen К. et al., 1984; Liedholm H., Melander A., 1984, и др.]. Механизм действия этих препаратов проявляется в блокаде поступления Ca2+ в цитоплазму мышечных клеток, в первую очередь миокарда, но также и других гладких мышц. Это способствует снижению потребности в кислороде сердца и других органов с гладкой мускулатурой, уменьшению периферического сосудистого сопротивления, что обеспечивает артериальную гипотензию. Происходит также снижение сократительной активности миокарда, миометрия. Гипотензивный эффект даже при высокой гипертензии проявляется быстро - через 5-10 мин, максимум - через 20 мин при энтеральном или сублингвальном приеме 10-20 мг нифедипина, сохраняется достаточно продолжительно - не менее 4 ч, особенно у больных, которым ранее были применены другие гипотензивные препараты [Lobbe W., 1984; Walters В., Redman С, 1984]. По данным U. Ulmsten (1984), применение нифедипина в снижающихся дозах по 30, 20 мг 3 раза в сутки энтерально в течение 3 дней, затем по 10 мг/сут до срока родов способствовало снижению сократительной деятельности миометрия и снижению АД так, что не требовалось дополнительной гипотензивной терапии. Препарат является эффективным токолитиком при угрозе преждевременных родов и гипотензивным средством. Не отмечено побочного действия на плод [Ulmsten U., 1984; Walters В., Redman С, 1984].
К гипотензивным препаратам с выраженным седативным и определенным противосудорожным действием относятся и производные барбитуровой кислоты, которые обладают угнетающим действием на сосудодвигательный центр и могут блокировать симпатические ганглии. В лечении позднего токсикоза используют барбитураты длительного и среднего действия: фенобарбитал, амибарбитал в дозе 250-500 мг при внутривенном введении [Treffers P., Smorenberg-Schoorl M., 1985, и др.].
В качестве гипотензивных средств при беременности, осложненной поздним токсикозом, также широко используют антиадренергические препараты центрального и периферического действия: аминазин, клофелин, резерпин и др.
Клофелин (гемитон, катапресан, клонидин), являясь гипотензивным средством центрального действия, одновременно дает седативный, снотворный эффект, в сочетании с диуретическими препаратами значительно увеличивает диурез. Клофелин для лечения артериальной гипертензии во время беременности использован М. М. Шехтманом и соавт. (1977). Он в большей степени снижает систолическое АД (в среднем на 25,7 мм рт. ст.), чем диастолическое (в среднем на 18,3 мм рт. ст.). Эффект развивается через 30-40 мин, сохраняется до 8 ч и более при энтеральном введении 0,075 мг (3-4 раза/сут) и продолжительности лечении в течение 8-9 сут. По данным К. Philipp и соавт. (1984), после лечения гипертензии беременных клонидином в дозе 0,15-0,30 мг/сут эффективно снижается АД, уменьшается выраженность клиники осложнений, что видно по снижению индекса гестозов Goecke. W. Lobbe (1984) относит клонидин к мощным антигипертензивным средствам, применяя его в сочетании с диазоксидом, магния сульфатом на 3-м этапе лечения, т. е. в случаях отсутствия эффекта от лабеталола, атеналола, допегита, гидралазина.
К антиадренергическим веществам центрального и периферического действия относится допегит (метилдофа), который получил широкое применение в акушерской практике в последние годы [Rasmussen К. et al., 1984, и др.]. По данным М. de Swiet (1985), метилдофа является препаратом выбора при позднем токсикозе, его эффективность особенно выражена при гипертензии в сроки до 28 нед беременности, а также при нетяжелом токсикозе в дозе 1500 мг/сут [Lobbe W., 1984]. Его применяют для лечения гипертонической болезни у беременных в 29-34 нед [During R., Schwarzlos G., 1985]. Последние авторы отметили значительный гипотензивный эффект метилдофа спустя 7-18 дней от начала лечения. Нет сообщений об отрицательном влиянии препарата на плод и последующее развитие детей до 7-летнего возраста [De Swiet M., 1985]. Вместе с тем метилдофа не показан при почечной недостаточности (снижает клубочковую фильтрацию), при энцефалопатии, вызванной артериальной гипертензией.
Алкалоиды раувольфии - резерпин, рауседил, раунатин и др. - также оказывают умеренный гипотензивный эффект, снотворное и седативное действие, уменьшают частоту сердечных сокращений. При энтеральном введении гипотензивный эффект развивается медленно, но сохраняется в течение нескольких дней после отмены препарата. Улучшают функцию почек - почечный кровоток и клубочковую фильтрацию. Препаратом неотложного лечения является рауседил при медленном внутривенном введении 1-2,5 мг. По данным I. Moriyama и соавт. (1978), резерпин, вводимый беременным животным, способствует гипотрофии плода, дефектам развития мозга, почек, костей черепа, кровотечениям из разных органов, высокой смертности новорожденных животных. W. Lobbe (1984) считает, что применение препаратов раувольфии (резерпина) нежелательно из-за отрицательного действия на плод - развития дистресс-синдрома с угнетением дыхания, нарушением терморегуляции. Кроме того, эти препараты не оказывают необходимого гипотензивного действия.
К антиадренергическим средствам преимущественно периферического действия относят β-адреноблокаторы - анаприлин (обзидан, индерал), изобарин (санотензин, исмелин), пиндолол, оксипренолол, лабеталол, атенолол и др. Эти препараты также нашли применение в последние годы в качестве антигипертензивных средств при позднем токсикозе беременных. Гипотензивное действие этих препаратов связано с уменьшением чувствительности барорецепторов к прессорным субстанциям (норадреналин). Они улучшают мозговой кровоток. Изобарин при энтеральном введении в дозе 15-40 мг/сут через 10-12 дней способствует снижению систолического АД в среднем на 27,9 мм рт. ст., диастолического АД в среднем на 18 мм рт. ст. [Шехтман М. М. и др., 1977]. Б. Атанасов и соавт. (1984) также с успехом используют изобарин (санотензин) в дозе 30-40 мг/сут и в комплексе с другими гипотензивными препаратами (депрессан, допегит, магния сульфат) для лечения позднего токсикоза беременных. Атенолол в суточной дозе 100 мг, лабеталол в суточной дозе 400 мг энтерально и другие β-адреноблокаторы при гипертензии у беременных используют J. Monnier и соавт. (1979), S. Högstedt и соавт. (1985) и др. P. Rubin (1984), P. Rubin и соавт. (1984), отмечая хорошие результаты лечения гипертензии беременных атенололом, не обнаружили отрицательного влияния препарата на сократительную деятельность миометрия, на плод и новорожденного при дальнейшем наблюдении за детьми в течение года Быстрое и значительное снижение АД получено при использовании лабеталола в начальной дозе 400 мг/сут и дальнейшем ее адаптировании к уровню АД. По данным A. Ellenbogen и соавт. (1986), β-адреноблокаторы (пиндолол в дозе 15 мг/сут) значительно эффективнее снижают систолическое и диастолическое АД, чем метилдофа, улучшают функцию почек, не дают побочных реакций у матери и плода, но в случаях артериальной гипертензии более 160/100 мм рт. ст. целесообразно лечение дополнять апресолином. Лучший по сравнению с метилдофа гипотензивный эффект окспренолола отмечен E. Gallery и соавт. (1985). Одновременно авторы отметили меньшую перинатальную смертность и лучший рост плодов в группе беременных с гипертензией, получавших окспренолол, по сравнению с таковыми, получавшими метилдофа. D. Dubois и соавт. (1984) применяют лабеталол с 200 мг/сут, постепенно увеличивают до 800 мг/сут, отмечают хорошую переносимость препарата и целесообразность назначения при раннем развитии гипертензии (до 24 нед). При длительном применении β-адреноблокаторы, в частности лабеталол, способствуют гипогликемии у матери и новорожденного [Gerard J. et al., 1984]. На это же осложнение только при проведении ганглионарной блокады - снижение содержания глюкозы крови в связи с симпатико-адреналовой блокадой указывает Л. П. Суханова (1983), которая подчеркивает необходимость назначения легкоусвояемых клеткой энергетических веществ, в первую очередь углеводов, при лечении больных токсикозом антиадренергическими средствами, нейролептиками.
В Советском Союзе для лечения высокой артериальной гипертензии в связи с поздним токсикозом беременных в течение ряда лет с успехом применяют ганглиоблокаторы, которые тормозят передачу возбуждения с преганглионарных сплетений на постганглионарные волокна [Ванина Л. В., 1985, и др.]. По данным Р. И. Калгановой и соавт. (1975), при проведении ганглионарной блокады в большей степени снижается систолическое АД (в среднем на 46 мм рт. ст.), чем диастолическое (в среднем на 21,5 мм рт. ст.). Л. В. Ванина (1985) полагает, что правильное проведение ганглионарной блокады позволяет отказаться от акушерских щипцов. Автор, а также К. М. Федермессер и соавт. (1982) используют для этих целей нитроглицерин (под язык, энтерально, внутривенно), а при аритмиях - обзидан. Применение указанных препаратов сопровождается постоянным (ежеминутным) измерением АД. Согласно D. Cotton и соавт. (1986), внутривенное введение нитроглицерина начиная с дозы 6 мкг/мин до снижения среднего АД на 20% обеспечивает коррекцию нарушений, приводящих к отеку легких у беременных с тяжелой гипертензией.
Эффект ганглионарной блокады выше, а требуемые дозы препаратов меньше при сочетании их с дроперидолом, седуксеном. Проведение ганглионарной блокады показано при высокой артериальной гипертензии, требующей срочной коррекции, при ведении родов на фоне значительно повышенного АД. Используют препараты - пентамин (50-100 мг) в течение 2-4-6 ч, имехин (10-15 мг), бензогексоний (25-50 мг) в 250-500 мл и более 5% раствора глюкозы; частоту капель регулируют по динамике АД и под его строгим контролем. В целях профилактики неуправляемой гипотензии нежелательно снижение систолического АД менее 135-140 мм рт. ст. Побочное влияние ганглиоблокаторов на плод проявляется учащением частоты сердечных сокращений, отклонениями КТГ. Около 12-15% беременных и рожениц резистентны к лечению этими препаратами. Л. П. Суханова (1983) обращает внимание на опасность ганглионарной блокады при заболеваниях ночек, поскольку в этих случаях максимально присутствуют кумулятивные побочные эффекты. Снижение АД у этих больных наблюдается спустя несколько часов после окончания ганглионарной блокады. Автор также отмечает высокий риск незамещенной кровопотери в условиях ганглионарной блокады, возможность развития острой асфиксии плода, особенно при расположении плаценты на передней стенке матки, что связано с ухудшением кровообращения в высоко расположенных отделах матки (области передней стенки в положении женщины на спине) - возникновение постуральной ишемии матки и плаценты в условиях ганглионарной блокады. Это осложнение можно предотвратить или уменьшить при повороте женщины на бок. R. During, G. Schwarzlos (1985) в комбинации с ганглиоблокаторами применяют дофамин, который, являясь предшественником катехоламинов, тем не менее, уменьшает сопротивление сосудов почек, увеличивает почечный кровоток и клубочковую фильтрацию, в связи с чем значительно увеличивается объем мочи. Ганглиоблокирующее действие оказывает новокаин при его внутривенном введении в виде 0,25-0,5% раствора. Возможны коллаптоидные реакции на препарат в связи со спазмолитическим действием преимущественно на уровне артериол и прекапиллярных сфинктеров [Тимошенко Л. В., Леуш С. С., 1981]. Недопустимо введение новокаина совместно с раствором глюкозы из-за образования комплексов, способствующих развитию анафилактических реакций. В. И. Алипов (1985) считает применение новокаина недостаточно оправданным из-за его быстрого разрушения и введения незначительных количеств.
Наконец, в группу антиадренергических средств можно отнести β-адреномиметики - изадрин, орципреналин (алупент), фенотерол (партусистен), ритодрин и др. Они способствуют умеренному снижению АД, не ухудшая плацентарного кровотока, что связано с их токолитическим действием на миометрий и избранным спазмолитическим эффектом на уровне артериол и капилляров. Эти препараты в качестве гипотензивных средств у больных поздним токсикозом применяются меньше, чем для лечения угрожающего невынашивания беременности, что связано с возможными побочными действиями на миокард [Атанасов Б. и др., 1984, и др.]. По данным J. Fouppila и соавт. (1985), внутривенное введение ритодрина в дозе 200 мкг/мин снижает систолическое и диастолическое АД, уменьшает резистентность сосудов плаценты, стимулирует синтез простациклина, оказывающего сосудорасширяющее действие, и ингибирует синтез тромбоксана A2, дающего сосудосуживающий эффект. J. Belch и соавт. (1985) для достижения гипотензивного эффекта при токсикозе предпочитают использовать не стимуляторы синтеза простациклина, а непосредственно препарат "простагландин I2".
К третьей группе гипотензивных средств относятся периферические вазодилататоры: апрессин, папаверина гидрохлорид, но-шпа, дибазол, натрия нитропруссид, диазоксид и др. Эффект всех этих препаратов проявляется на уровне периферических сосудов, главным образом артериол, в связи с непосредственным влиянием на гладкую мускулатуру сосудов, блокадой сосудосуживающего действия норадреналина и другими механизмами.
Диазоксид обеспечивает выраженную гипотензию, но при этом задерживает в организме воду и натрий, способствует гипергликемии, тахикардии. Поэтому применение препарата противопоказано при отеке легких, почечной недостаточности. Рекомендуют его назначение совместно с диуретическими препаратами. Оказывают токолитическое действие на миометрий. Так как препарат быстро связывается в кровотоке с белками, для достижения терапевтического эффекта необходимо введение его в больших дозах (200-400 мг/сут и более). Препарат применяют в неотложных ситуациях при необходимости быстрого снижения АД [Sankar D., Moodley J., 1984; de Swiet M., 1985, и др.]. По данным J. Morris и соавт. (1977), внутривенное применение диазоксида в дозе 300 мг в течение 10 с при эклампсии и преэклампсии способствовало снижению систолического и диастолического АД через 5-15 мин после инъекций; гипотензия сохранялась до 4 ч. Более осторожные выводы сделаны D. Sankar, J. Moodley (1984), которые наблюдали тяжелую гипотензию па введение диазоксида в средней дозе 158 мг у 30% беременных. Они полагают, что для достижения эффекта достаточно 60 мг препарата; при среднем АД 105 мм рт. ст. и ниже его введение следует прекратить. Еще больше побочных реакций описано D. Dudley (1985), который применял при высокой артериальной гипертензии дробное введение 120 мг препарата в среднем (до снижения диастолического АД до 90 мм рт. ст.). По его мнению, использование диазоксида требует дополнительного применения диуретических и антигипертензивных средств, у больных наблюдаются нарушения функции почек, сердца, ишемия мозга, а у плода - брадикардия, дистресс-синдром. Н. Liedholm, A. Melander (1984) считают, что в настоящее время на смену диазоксиду появился лабеталол.
Периферическим вазодилататором является также апрессин (гидралазин, апресолин, депрессан и др.) и близкий к нему по механизму действия дигидралазин (непрессол и др.). Препараты используют в основном энтерально. Для внутривенного, внутримышечного введения пригоден гидралазин. Действие проявляется медленнее, чем у диазоксида, - в течение 15-20 мин при внутривенном введении, больше снижается диастолическое АД, уменьшается общее периферическое сосудистое сопротивление, повышаются частота сердечных сокращений, ударный и минутный объем сердца, улучшается почечный и мозговой кровоток. По данным J. Pritchard и соавт. (1984), внутривенное введение гидралазина при высокой артериальной гипертензии (диастолическое АД 110 мм рт. ст. и более) предупреждает внутричерепные кровоизлияния. Начальная доза препарата - 5 мг. Введение может быть повторено (максимальная общая доза - 20 мг) до снижения диастолического АД (100 мм рт. ст. и ниже). Существуют и другие методы введения гидралазина: по 5 мг препарата с интервалом в 20 мин или постоянное капельное введение на 5% растворе глюкозы; энтеральное введение до 50 мг/сут, а при отсутствии заметного снижения диастолического АД - до 100 мг/сут [H6gstedt S. et al., 1985]. По данным S. Thiagarajah и соавт. (1984), введение гидралазина обязательно в случаях энцефалопатии, связанной с высокой артериальной гипертензией. Те Lin Liu (1982) считает, что в этих случаях общая доза гидралазина может быть увеличена до 20-40 мг при внутривенном капельном введении. A. Skret и соавт. (1984) аналогичный положительный эффект на гемодинамику при позднем токсикозе наблюдали при внутривенном введении 12,5 мг дигидралазина с последующим энтеральным приемом но 25 мг через каждые 0 ч. Через 30 мин после введения препарата у больных с "чистым" и сочетанным токсикозом на 34,6 и 57% соответственно увеличивался минутный объем сердца, на 48 и 15,5% снижалось периферическое сосудистое сопротивление, этот эффект удерживался до 24 ч. В то же время имеются данные о не всегда благоприятном влиянии препаратов группы гидралазина на плод [Högstedt S. et al., 1985]. В связи с этим его целесообразно "вводить только при АД более 160/110 мм рт. ст. [Knuppel R., Montenegro R., 1983].
К группе периферических вазодилататоров относится и натрия нитропруссид, один из старейших препаратов этой группы, к которому в последнее время вновь возник интерес в связи с его выраженным спазмолитическим действием на мускулатуру артериол, способностью уменьшать потребность тканей в кислороде [De Swiet M., 1985, и др.]. Препарат в дозе 50 мг вводят внутривенно на 5% растворе глюкозы со скоростью 1-4 мкг/мин.
К периферическим сосудорасширяющим и спазмолитическим средствам относится дибазол, который при внутривенном введении в дозе 30-40 мг вызывает непродолжительное расширение мозговых сосудов [Романова Э. Ф., 1973], достаточно эффективны при лечении гипертензии, связанной с поздним токсикозом беременных [Деранкова Е. В., 1961], папаверин, но-шпа и другие препараты.
Изучаются и другие возможности лечения артериальной гипертензии у беременных: применение ингибитора генерации ангиотензина II, антагониста системы ренин - ангиотензин каптоприла, ингибитора серотонина кетансерина [Liedholm H., Melander A., 1984; Weiner G. et al., 1984, и др.]. Сведения об их эффективности и побочном действии разноречивы, и есть данные, что каптоприл вызывает тяжелую депрессию сердечной деятельности и дыхания у новорожденных, увеличивает в 6 раз частоту мертворождений.
Беглый обзор гипотензивных препаратов, применяемых для лечения позднего токсикоза беременных, свидетельствует, во-первых, об их большом числе и разном механизме действия, что позволяет осуществить индивидуальный подбор, эффективно их комбинировать; во-вторых, о наличии у всех без исключения гипотензивных средств тех или иных побочных эффектов, особенно в отношении плода, что делает не всегда желательным их применение у беременных с поздним токсикозом. Поэтому многие врачи не применяют их в обычном лечении токсикоза, если нет высокой артериальной гипертензии и, следовательно, не угрожают церебральные нарушения, отек легких. Также учитывают, что действие гипотензивных препаратов уменьшается при одновременном назначении седативных средств, транквилизаторов, которые усиливают ферментные процессы в печени и, следовательно, ускоряют процесс конъюгирования гипотензивных лекарств. Кроме того, как указано выше, гипотензивные и другие препараты, используемые при позднем токсикозе, не обеспечивают истинною излечения, а являются симптоматическими, лишь уменьшая или убирая тот или иной симптом. R. During, A. Jorn (1985) отметили, что лечение токсикоза гипотензивными препаратами снижает через 1-2 нед АД и массу тела, однако даже при интенсивном лечении тяжелого токсикоза клинические и лабораторные показатели существенно не улучшаются.
В то же время назначение гипотензивных средств необходимо и обязательно при высокой артериальной гипертензии (систолическое АД 150-160 мм рт. ст. и более, диастолическое - 100 мм рт. ст. и более) в целях профилактики энцефалопатии, развития приступов эклампсии и кровоизлияния в мозг.
Гипотензивная терапия оказалась самым слабым звеном в лечении позднего токсикоза беременных - имела место значительная недооценка этого компонента в комплексной интенсивной терапии. Фактически ни у одной больной гипотензивное лечение не оказалось излишне большим по объему, но у всех - недостаточным. Во время пребывания в отделении патологии беременных больные получали стереотипное лечение глюкозой, новокаином, дибазолом, папаверином, димедролом, эуфиллином. При этом утяжеление клиники заболевания оставалось недостаточно учтенным при этапных оценках динамики позднего токсикоза.
1. Беременная К. находилась в отделении патологии беременности в течение месяца в связи с нефропатией. АД 140/90-130/90-140/100 мм рт. ст. Лечение заключалось во внутримышечном введении растворов дибазола и папаверина два раза в сутки. Диагноз при выписке: беременность 32 нед. Токсикоз 11 половины беременности. Вегетососудистая дистония по гипертоническому типу.
Повторно поступила через 17 дней. АД 170/110-150/100-190/100 мм рт. ст. 'Жалобы на головную боль. Повторно назначены внутримышечные введения растворов дибазола, папаверина, внутривенно назначены растворы глюкозы, новокаина, эуфиллина. Проведен курс лечения магния сульфатом.
2. Беременная П. находилась в отделении патологии беременности в течение 6 нед. За это время отмечены повышение АД (исходное АД 120/80-130/90 мм рт. ст.; к концу пребывания в отделении 150/110-140/110 мм рт. ст.), изменения на ЭКГ, снижение суточного объема мочи, нарастание степени протеинурии, гемоконцентрация (исходная концентрация Hb 120 г/л, к концу пребывания - 140 г/л). В течение первых 4 нед назначены дибазол, папаверин внутримышечно, глюкоза (40% раствор 20 мл) с сигетином внутривенно, витамины, эуфиллин, проведен курс магнезиальной терапии. В последующие 2 нед это лечение продолжено, но дополнительно назначены периодические внутривенные инфузии растворов глюкозы и новокаина.
Необходимо еще раз отметить высокую зависимость тяжелых поражений мозга, особенно кровоизлияния в мозг, от уровня артериального давления. Опасность эклампсии, кровоизлияния в мозг при высокой артериальной гипертензии резко увеличивается в периоде "предвестников родов, при родовозбуждении, в начале и конце периода раскрытия, в периоде изгнания. Следовательно, эти периоды должны быть особенно защищены назначением гипотензивных препаратов с учетом их эффективности, адекватных доз и путей введения. Вместе с тем гипотензивные препараты у 11 больных не применялись, у 11 применялись в недостаточном объеме: в основном использован внутримышечный путь введения дибазола, папаверина гидрохлорида, иногда с дополнительным энтеральным назначением изоверина, депрессина. В 4 случаях применены ганглиоблокаторы, но в одном из них ганглионарная блокада арфонадом начата с опозданием на 5-6 ч, в остальных внутримышечно применен пентамин в дозе 50-150 мг, что не оказало необходимого гипотензивного действия, АД сохранялось на цифрах 160/120-190/130 мм рт. ст.
Следует считать недопустимым проведение родовозбуждения на фоне артериальной гипертензии 160/100 мм рт. ст. и более, замену гипотензивного лечения симптоматическим назначением препаратов аналгезирующего действия (анальгин, баралгин и др.), длительное и повторное применение одних и тех же препаратов, несмотря на отсутствие их лечебного эффекта в динамике наблюдения. Учитывая плохую переносимость беременными женщинами высокой артериальной гипертензии, большой риск в этих случаях развития необратимых поражений мозга вплоть до геморрагического инсульта, при лечении тяжелых форм позднего токсикоза необходимо учитывать реальную эффективность гипотензивных препаратов в каждом отдельном случае.
Еще раз следует подчеркнуть, что магния сульфат, являясь хорошим противосудорожным средством, не всегда обеспечивает достаточное снижение АД, в связи с чем его необходимо комбинировать с назначением гипотензивных средств.
Роженица Ч. доставлена с начавшимися схватками, эклампсией вне лечебного учреждения. При поступлении сознание спутанное, двигательное возбуждение, частота дыханий 34 в 1 мин, пульс 150 уд/мин, ЛД 180/100 мм рт. ст., тремор, гипертонус мышц конечностей, обширные отеки. Роды II срочные (первые роды год назад). Двойня. Осуществлена интубация трахеи, начата ГШЛ. При влагалищном исследовании обнаружена сглаженная шейка матки, раскрытие маточного зева 8-9 см. Произведена амниотомия. Начат курс магнезиальной терапии. Внутривенно применены 0,5% раствор новокаина - 100 мл, пентамин 50 мг фракционно. К периоду изгнания АД 170/120-200/120 мм рт. ст. Роды закончены наложением акушерских щипцов на головку 1-го плода, извлечением за ножку 2-го плода под эндотрахеальным наркозом (закись азота, дроперидол и др.). Кровопотеря оценена в 100 мл.
В данном случае была избрана в целом правильная тактика ведения родов с адекватным анестезиологическим пособием. Тем не менее не обеспечено достаточное лечение артериальной гипертензии. Магния сульфат, сняв гиперрефлексию, оказался неэффективным в регуляции АД.
Лечение позднего токсикоза в родах, вернее - защита организма роженицы от патофизиологических и клинических проявлений позднего токсикоза, всегда должна быть усилена. Можно полагать, что не меньшую опасность, чем родовой акт, представляют для больной первые часы и дни послеродового периода, так как адаптация всех органов и систем к новым условиям существования организма протекает на фоне тяжелых морфологических и функциональных изменений в связи с поздним токсикозом, усиленных перенесенным родовым стрессом.
Недооценка этого обстоятельства и недостаточная коррекция клиники токсикоза, в том числе высокой артериальной гипертензии, отмечена у части родильниц. Это облегчало развитие эклампсии, других осложнений токсикоза. Как и во время беременности, родов, в послеродовом периоде не всегда достаточно эффективно проводят гипотензивную терапию, несмотря на сохранение высокой артериальной гипертензии.
Наконец, непонятным остается смысл одновременного назначения магния сульфата и препаратов кальция (кальция хлорид, кальция глюконат). Подобное сочетание отмечено при лечении позднего токсикоза во время беременности, родов и послеродового периода у 10 больных. Препараты кальция назначали или одновременно с магния сульфатом или спустя 2-4-6 ч, но на фоне проводимой магнезиальной терапии. Основанием для их применения были кожный зуд, профилактика изосерологических нарушений при гемотрансфузии, стремление улучшить сократительную функцию миокарда, повысить гемокоагуляционные свойства крови. Вместе с тем очевидно, что кожный зуд зависел от нарушения функции печени при токсикозе, а для достижения лечебного эффекта при других осложнениях следовало использовать иные лечебные препараты: в силу антагонизма Ca2= и Mg2+ совместное назначение лекарств, их содержащих, не обеспечит ожидаемого терапевтического действия. В работах, посвященных лечению позднего токсикоза магния сульфатом, антагонизм ионов кальция и магния подчеркивал Д. П. Бровкин (1953). Показанием к применению препаратов кальция при лечении магния сульфатом может быть только передозировка последнего и в связи с этим необходимость его нейтрализации. Назначение этих средств с расчетом на разный механизм их действия при одновременном введении нецелесообразно и недопустимо.
Следует также обратить внимание на необходимость более осторожного использования кальция хлорида, кальция глюконата у больных с тяжелыми формами позднего токсикоза - при преэклампсии, эклампсии, на фоне повышенной судорожной готовности. Эти препараты на фоне иных, чем магния сульфат, противосудорожных средств по разным причинам применены у двух больных. У одной из них в течение 3 сут введено 110 мл 10% кальция хлорида, все эти дни сохранялась повышенная судорожная готовность с повторными приступами эклампсии, несмотря на ИВЛ, назначение наркотических, нейролептических и других средств.
В течение последнего десятилетия значительно пересмотрена целесообразность лечения позднего токсикоза диуретиками: в условиях гиповолемии, гипоальбуминемии, когда затруднена мобилизация интерстициальной жидкости, применение диуретиков способствует еще большему уменьшению объема плазмы, дальнейшей гемоконцентрации, углубляет нарушения электролитного и водно-солевого баланса в целом. Эффект от назначения диуретиков (уменьшение отеков и снижение массы тела) часто непродолжителен и не выражен. Вместе с тем усиление периферического сосудистого спазма в ответ на снижение объема плазмы способствует развитию артериальной гипертензии (обратный эффект применения диуретических препаратов). Поэтому изыскивают другие пути улучшения функции почек - постельный режим, положение на левом боку, физические методы лечения, включая микроволновую терапию, ультразвук в прерывистом режиме на зону кожной проекции почек, ванны, проведение сеансов гипербарической оксигенации и др. [Бодяжина В. И. и др., 1977; Иванов И. П., 1985; Терешин П. П., Чарушникова Г. А., 1985; Goodlin R. et al., 1984, и др.]. По данным А. Ф. Жаркина, Т. И. Костенко (1985), курс иглорефлексотерапии из 10-12 сеансов у беременных с нетяжелыми формами позднего токсикоза обеспечивает повышение холинергического влияния, что проявляется в увеличении латентного периода сосудистой реакции на адреналин, уменьшении - на карбахолин, снижении адреналино-карбахолинового индекса. По данным Т. И. Акулич, Ю. К. Малевич (1985), эффективно лечение нетяжелых форм позднего токсикоза с применением лазеротерапии, электроаналгезии. В. Дончев, А. Кацулов (1985) и др. отмечают положительную динамику в клинике позднего токсикоза при назначении постельного режима с положением больных на левом боку.
Применение диуретических препаратов, способствуя гемоконцентрации, гиповолемии, углубляет гипоксию паренхиматозных органов, в том числе почек, что в дальнейшем приводит к олигурии. Ухудшается маточно-плацентарное кровообращение, что способствует гипоксии плода. По данным В. Lindberg (1984) и др., диуретические препараты могут способствовать рождению детей с низкой массой тела, развитию гипонатриемии, гипокалиемии, метаболического ацидоза и тромбоцитопении у новорожденных детей.
По данным J. Davison (1984), общий объем жидкости при беременности увеличивается на 6-8 л, в том числе интерстициальной - на 4-6 л, задерживается 950 ммоль/л натрия. Иные условия, в которых функционируют сердечно-сосудистая система, почки и другие органы при беременности, заставляют осторожно относиться к медикаментозной регуляции водно-солевого баланса, учитывать как клинические, так и лабораторные параметры. Например, при концентрации мочевины 5 ммоль/л и меньше введение осмодиуретических препаратов способствует задержке интерстициальной жидкости, усилению отека паренхиматозных органов. В то же время в этих условиях эффективны салуретики [Малышев В. Д., 1985]. Б. И. Медведев, А. А. Астахов (1982) добились значительного улучшения в исходах тяжелых форм позднего токсикоза беременных регуляцией АД, ограничением введения жидкости и отказом от применения диуретиков, если нет срочных показаний к их назначению. По данным В. Sibai и соавт. (1984), прирост ОП на фоне диуретических препаратов у беременных с гипертонической болезнью в 26-32 нед составил только 18%, в то время как ведение таких же больных без диуретиков способствовало приросту ОП на 52%. G. Hankins и соавт. (1984) считают, что мобилизация внеклеточной жидкости при эклампсии достигается назначением магния сульфата, гидралазина и ограничением жидкости, а Г. Д. Дживелегова и соавт. (1984), R. Groenendijk и соавт. (1984), А. Кацулов и соавт. (1984) и др. полагают, что гиповолемия в сочетании с генерализованным отеком и за счет этого низкое ЦВД делают необходимым введение растворов (изо-гиперосмотических), что способствует увеличению ОП, нормализации ЦВД и реологических свойств крови. Категорически возражают против применения диуретических препаратов у беременных с поздним токсикозом А. Кацулов и соавт. (1985), J. Pritchard и соавт. (1984), и др.
В то же время следует отметить, что разногласия относительно целесообразности назначения диуретиков у больных поздним токсикозом носят несколько искусственный характер, и те же авторы, которые выступают против их назначения, тем не менее, оговаривают показания, когда их следует применять: острая почечная недостаточность, отек легких, отек мозга и др.
Совершенно очевидно, что в интенсивном лечении позднего токсикоза беременных невозможно обойтись без диуретических препаратов. Вопрос заключается лишь в том, когда их следует и когда не следует назначать, а также какие препараты из обилия диуретических лекарственных форм лучше использовать.
Нет сомнения, что гемокомцентрация и гиповолемия, свойственные позднему токсикозу, не должны усиливаться назначением диуретиков, так как задача диуретической терапии и, если шире, инфузионной осмоонкотерапии заключается в мобилизации интерстициальной жидкости с восстановлением ОП и удалением из организма избыточных объемов воды. При кажущейся теоретической легкости на практике решение этой задачи затруднительно, так как мобилизация объемов одними и теми же препаратами будет различной у разных больных, следовательно, стандартизация подходов к лечению не всегда окажется эффективной. Например, такой симптом, как олигоанурия (суточный объем мочи 400 мл и менее) может быть следствием почечной недостаточности, а может быть результатом гиповолемии. В первом случае назначение диуретических препаратов необходимо и может дать желаемый эффект, тогда как во втором будет способствовать углублению гиповолемии со всеми вытекающими последствиями для организма, вплоть до развития необратимого состояния. С подобными ситуациями в клинической практике приходится встречаться ежедневно как при ведении беременных с тяжелыми формами позднего токсикоза, так и при ведении родильниц, у которых роды (тем более - на фоне тяжелого позднего токсикоза) осложнились значительной патологической кровопотерей. Очевидна необходимость в этих ситуациях до назначения диуретиков провести пробную инфузию (до 1000 мл, что зависит от конкретного случая), чтобы разобраться в причине анурии и избрать соответствующую тактику.
Что касается конкретных лекарственных форм диуретических средств, то в силу различного вида побочных действий многие из них никогда не должны использоваться у беременных с поздним токсикозом. Это становится очевидным из беглого обзора диуретических препаратов, которыми располагает сегодняшняя медицина.
Выделяют 4 группы препаратов: салуретики, калийсберегающие, осмотические и диуретики разных групп.
В акушерской практике в течение ряда лет достаточно широко используют салуретики. Это тиазидные и тиазидоподобные препараты (гипотиазид или дихлотиазид, циклометиазид), "петлевые" диуретики, эффект которых проявляется на протяжении всего нефрона, включая петлю нефрона (фуросемид, или лазикс, клопамид, этакриновая кислота, или урегит) и ингибиторы карбоангидразы (диакарб). Почти все салуретики оказывают гипотензивное действие, что в значительной степени связано с уменьшением содержания натрия в сосудистых стенках и вследствие этого снижением их чувствительности к прессорным субстанциям. В то же время тиазидные производные значительно ухудшают клубочковую фильтрацию, что делает нежелательным их применение при почечной недостаточности у больных поздним токсикозом. При лечении тиазидными препаратами возрастает концентрация мочевой кислоты, что нежелательно и может менять представление о тяжести позднего токсикоза [Lincffoerg В., 1984: de SwietM., 1985]. Интенсивно теряются калий и натрии, возможно развитие сердечных аритмий [Ванина Л. В., 1985].
Фуросемид, урегит также интенсивно выводят натрий, калий, способствуя возникновению аритмий, повышению концентрации в плазме мочевой кислоты, мочевины, способствуют нарушению углеводного обмена, снижая толерантность к глюкозе. Эффект от введения фуросемида (лазикса) наступает очень быстро - в ближайшие минуты, сохраняется 3-8 ч (в основном до 2-3 ч). Эти препараты в отличие от тиазидных средств не угнетают клубочковую фильтрацию, в связи с чем их можно применять при Почечной недостаточности. Показания к применению - неотложные состояния при токсикозе: отек легких, отек мозга, анурия, острая левожелудочковая недостаточность. Г. М. Савельева (1982) допускает назначение лазикса (20 мг одномоментно) В целях регуляции водно-солевого обмена при проведении инфузионного лечения позднего токсикоза.
Диакарб оказывает очень непродолжительное диуретическое действие, но способствует уменьшению внутричерепного и внутриглазного давления, увеличивает выведение натрия гидрокарбоната, фосфатов.
Калийсберегающие диуретики - ингибиторы альдостерона (спиронолактон или верошпирон, альдактон и др.) и блокаторы проницаемости натрия (триамтерен, амилорид и др.) - обеспечивают уменьшение экскреции ионов калия и натрия, непригодны для неотложного лечения, так как эффект проявляется на 2-3-й сутки, противопоказаны при почечной недостаточности.
К осмотическим диуретикам относят маннитол, калия ацетат; в значительной степени этими свойствами обладает сорбитол. Эти препараты используют при проведении инфузионной осмоонкотерапии у больных токсикозом.
Таким образом, из многих диуретических средств целесообразно использовать при позднем токсикозе беременных фуросемид (лазикс), другие представители этой группы - в силу быстрого наступления эффекта, отсутствия угнетающего влияния на клубочковую фильтрацию, в определенных ситуациях допустимы диакарб, осмодиуретики, что должно сочетаться с инфузионным лечением.
Любое инфузионное лечение включает в себя два аспекта: объем инфузий и качество вводимых растворов. Инфузионное лечение позднего токсикоза не составляет в этом плане исключения. Его параметры были достаточно оговорены па страницах журнала "Акушерство и гинекология", на Всесоюзном пленуме, посвященном позднему токсикозу беременных (1985) [Савельева Г. М., 1985; Серов В. Н., Маркин С. А., 1985, и др.].
Объем вводимых растворов должен быть таким, чтобы не ухудшать еще больше функциональное состояние сердечно-сосудистой системы, не углублять отек паренхиматозных и других органов, т. е. достигать не более 1200-1600 мл, в отдельных случаях - не более 2000 мл, при условии адекватного диуреза. На эти объемы известное влияние оказывают периоды, в которые проводят лечение (беременность, родовой акт, послеродовой период). Для контроля за общим объемом инфузионного лечения и профилактики недостаточности миокарда, отека легких целесообразно измерять ЦВД [Малышев В. Д., 1985; Серов В. Н., Маркин С. А., 1985; Rasmussen K. et al., 1984].
Представляется неоправданным стремление некоторых авторов ограничивать инфузионное лечение позднего токсикоза применением одних изотонических или, напротив, одних гипертонических растворов [J. Pritchard et. al., 1984, и др.]. U. Siekmann и соавт. (1986) считают, что обеспечивают гиперволемическую гемодилюцию введением 500 мл декстрана-40, а нормоволемическую - введением 500 мл изотонического раствора натрия хлорида, хотя в первом случае эффект на кровообращение матери и плода очень непродолжителен, а во втором отсутствует вообще. Совершенно очевидно, что одни изотонические растворы не могут эффективно и длительно восстановить ОП, при их введении возрастает риск усиления гидратации с прогрессирующим отеком мозга, других органов. Вряд ли также возможно инфузионное лечение позднего токсикоза основывать на применении одних только гиперосмотических растворов: без сочетания с изотоническими средами они также не всегда восстанавливают ОП, скорее способствуют нарушениям электролитного баланса с развитием гипернатриемии, гиперосмии.
В целом возможности выбора тех или иных растворов при позднем токсикозе не так уж велики. К изотоническим (изоосмотическим) относят 5% раствор глюкозы (осмоляльность 280 мосм/кг воды), растворы солей: лактасол, раствор Рингера, изотонический раствор натрия хлорида, хлосоль (раствор, обогащенный калием), трисоль (включает калия хлорид, натрия хлорид, натрия гидрокарбонат), некоторые другие (осмоляльность их равна 280-300 мосмоль/кг воды), также 0,3 М раствор трис-буфера, плазму (осмоляльность 290 мосмоль/кг воды).
Гипертонические (гиперосмотические), объемные растворы: 10% и более раствор глюкозы, альбумин (5-10-20%), плазма, кровь (по объемному действию и осмотической активности), а также синтетические коллоидные растворы (реополиглюкин). Эти препараты дают объемный эффект, обеспечивают в известных пределах мобилизацию внесосудистой жидкости, улучшают реологические свойства крови. Осмотический эффект дают маннитол и сорбитол.
Все указанные растворы давно и всесторонне испытаны у больных поздним токсикозом, хорошо известны и хорошо зарекомендовали себя при практическом применении. Тем не менее выводы о целесообразности использования некоторых из этих сред у больных токсикозом до сих пор противоречивы. Например, очевидно значение альбумина в увеличении 011, восстановлении периферического кровообращения [Ильин И. В. и др., 1977; Расстригин Н. Н., 1978; Иванов И. П., 1986, и др.]. К. Rasmussen и соавт. (1984) при тяжелом позднем токсикозе беременных обязательно начинают лечение с внутривенных инфузий альбумина (100 мл/ч) в сочетании с изотоническим раствором натрия хлорида (100-200 мл/ч) в течение максимально 5 ч. В результате у всех больных наблюдают увеличение диуреза, восстановление ОП, что нормализует органную перфузию и улучшает прогноз для матери и плода. С другой стороны, P. Zouppila и соавт. (1983) не используют инфузий альбумина у беременных с поздним токсикозом, так как, по их мнению, он не улучшает кровоток в плаценте, а Te Lin Lin (1982), А. Кацулов и соавт. (1985) и др. предпочитают альбумину низкомолекулярные декстраны.
Наверное, такое ограничение инфузионного лечения одной-двумя средами нецелесообразно, уменьшает возможности более эффективного влияния на больной организм. Однако, приступая к инфузионному лечению больных поздним токсикозом, следует учитывать его возможные последствия в плане серьезных нарушений водно-электролитного гомеостаза. Исследования В. Н. Серова, С. А. Маркина (1985) показали целесообразность выполнения у больных поздним токсикозом управляемой гемодилюции с учетом исходного состояния, общей коллоидно-осмотической нагрузки, ответной реакции организма. При гипертоническом варианте водно-солевого гомеостаза (гиповолемия, гемоконцентрация, гипоальбуминемия) показана изоволемическая гемодилюция с точным расчетом дозы кристаллоидов или комбинация гиперволемической гемодилюции с управляемой артериальной гипотензией. При гидратации (отечный вариант позднего токсикоза) необходима изоволемическая гемодилюция, но с применением коллоидных растворов.
В процессе беременности, родов могут быть одни требования к инфузионному лечению тяжелых форм позднего токсикоза (максимальное устранение гиповолемии, восстановление реологических свойств крови и, следовательно, органного кровотока, профилактика и лечение начальных стадий синдрома ДВС и др.), тогда как в послеродовом периоде к этим требованиям возможно добавление других (необходимость замещения как плазменного, так и глобулярного объемов, лечение острых нарушений гемостаза и др.). Кроме того, в случаях тяжелых форм позднего токсикоза нарушения функции жизненно важных органов часто прогрессируют в первые часы и дни послеродового периода, что также меняет подходы и их коррекции.
Так, в процессе стационарного лечения на этапах беременности и родов большинство больных получали разного объема лечение, направленное на коррекцию гемореологических нарушений. Ограниченно назначали диуретические препараты во время беременности лишь у 7 больных, в том числе лазикс в одном случае, гипотиазид - у 6 (в женской консультации диуретические препараты применены лишь у 5 больных, в том числе у 2 - гипотиазид, у одной - диакарб). Следует отметить их безусловную неэффективность в лечении тяжелых форм позднего токсикоза без сопутствующих инфузий - во всех случаях сохранялись выраженные отеки, высокая артериальная гипертензия, оставался недостаточным диурез. В то же время добавление инфузий реополиглюкина, альбумина, 5% раствора глюкозы, лактасола в количестве 800-1200 мл способствовало увеличению объема мочи, тенденции к снижению АД, улучшению общего самочувствия.
Попутно следует отметить необходимость более осторожного использования эуфиллина, который многократно в течение ряда дней применен фактически у всех больных. Целесообразность включения эуфиллина в число лекарственных препаратов при позднем токсикозе беременных объясняется многими его положительными свойствами: увеличивает почечный кровоток, снижает канальцевую реабсорбцию, что проявляется увеличением диуреза, снижает периферическое сосудистое сопротивление, в том числе сосудов мозга. Вместе с тем препарат способствует повышению потребностей миокарда в кислороде, развитию аритмий, может провоцировать появление судорожных приступов. По данным Л. В. Тимошенко, С. С. Леуш (1981), при его применении сохраняются нарушения оттока крови из сосудов мозга, поэтому его следует с осторожностью назначать при некомпенсированной гиповолемии.
Это обстоятельство заслуживает особого внимания при назначении эуфиллина во время родов, осложненных поздним токсикозом, тем более если отсутствует одновременное инфузионное лечение гиповолемии. Инфузионное лечение с применением реологически активных веществ, солевых растворов особенно необходимо в случаях родов, осложненных синдромом ДВС, клиническими проявлениями которого являются примесь крови в рвотных массах, моче, повышенная кровоточивость после инъекций, тем более - преждевременная отслойка нормально расположенной плаценты. Ошибочно в этих случаях, когда налицо тяжелые клинические проявления гиповолемии и потребность в инфузионном лечении особенно велика, применять вместо него эуфиллин, лазикс, другие диуретики.
Беременная С. доставлена в крайне тяжелом состоянии после 4 приступов эклампсии при доношенной беременности. Заторможена, контакт затруднен. Генерализованный отек. Рвота с примесью крови. В носовых ходах и полости рта геморрагическое содержимое. АД 180/110-190/110 мм рт. ст., пульс 132 уд/мин. В легких единичные влажные хрипы. Частота дыхания 28-30 в 1 мин. Объем мочи 180 мл. Содержание белка в моче 33 г/л. Дан масочный наркоз фторотаном и закисью азота с кислородом. Начато введение магния сульфата по схеме, применены дроперидол, седуксен, гипотензивные препараты. Одновременно введены лазикс 80 мг, эуфиллин 2,4% - 10 мл, 40% раствор глюкозы 10 мл. Введен желудочный зонд, по которому поступает содержимое цвета "кофейной гущи". Еще через час решено провести инфузию. К этому времени диурез 300 мл. Введены 5% раствор альбумина - 100 мл, 10% раствор глюкозы - 200 мл. Через 5 ч после поступления повторился приступ эклампсии. Объем мочи к этому времени 1050 мл, определяется примесь крови. Дополнительно введены 2,4% раствор эуфиллина - 10 мл, 40% раствор глюкозы - 10 мл, лазикс 60 мг. Начата ганглионарная блокада арфонадом на 200 мл 5% раствора глюкозы. Повторная рвота с примесью крови. АД 120/80 мм рт. ст., состояние без положительной динамики, в связи с чем через 10 ч от поступления в стационар под эндотрахеальным наркозом произведена операция кесарева сечения - извлечен живой мальчик длиной 50 см, массой 3050 г. Кровопотеря оценена в 200 мл. Во время операции введено 400 мл желатиноля.
После операции оставлена на ИВЛ. Состояние тяжелое. АД 140/100-130/100, затем 140/120 мм рт. ст. За 4 ч после операции введены следующие растворы: натрия гидрокарбоната 4% раствор - 200 мл; раствор альбумина 10% - 200 мл, маннитол 30 г в изотоническом растворе натрия хлорида. Всего введено 600 мл растворов; объем мочи с окончания операции 800 мл. Продолжена ганглионарная блокада и увеличен дальнейший объем инфузии с добавлением 5 и 10% растворов глюкозы, альбумина, натрия хлорида и др. Всего за сутки введено 2200 мл растворов. Суточный объем мочи 2690 мл. В последующие дни объем инфузий составлял около 2 л, что соответствовало диурезу.
Таким образом, при поступлении больной в стационар была недооценена тяжесть гемореологических нарушений, проявлением которых была и клиника синдрома ДВС (примесь крови в рвотных массах, моче). В связи с этим не начали своевременно инфузионное лечение, направленное на коррекцию гиповолемии, а приступили к интенсивной стимуляции диуреза лазиксом и эуфиллином. Это лечение способствовало углублению тяжести гиповолемии, нарушений органного кровотока и гипоксии, следствием чего оказалась недостаточной реакция на стимуляцию диуреза, не купирована клиника синдрома ДВС, повторился приступ эклампсии. Этому же способствовал запоздалый перевод на ИВЛ (только перед операцией кесарева сечения). Недостаточное по объему инфузионное лечение было в процессе операции кесарева сечения ив первые часы после операции, чему частично способствовал неверный учет операционной кровопотери (200 мл).
Очень сложным и трудно решаемым моментом в лечении позднего токсикоза является компенсация патологической кровопотери во время родов. Нередко наблюдаются две крайности: во-первых, в борьбе с акушерскими кровотечениями забывают о сопутствующем тяжелом токсикозе, о необходимости в связи с этим соответствующей коррекции лечения и четкой профилактики недостаточности жизненно важных органов в связи с возможным углублениям нарушений их функции за счет наслоения острой гипоксии на неблагоприятный хронический фон. Во-вторых, считая поздний токсикоз препятствием к значительной по объему трансфузионно-инфузионной терапии, недооценивают значение замещения кровопотери в плане ближайших и отдаленных осложнений, не обеспечивают таким образом адекватную защиту организма, не восстанавливая необходимый эритроцитарный объем.
Недостаточная и несвоевременная компенсация кровопотери приводит к необходимости применения средств, не очень желательных при токсикозе в связи со стимуляцией судорожной готовности, ухудшением условий периферического кровообращения, резким гипертензивным эффектом (кальция хлорид, фибриноген, контрикал, мезатон, норадреналин, большие дозы глюкокортикоидов и др.).
Беременная Б. Операция кесарева сечения в связи с преждевременной отслойкой нормально расположенной плаценты на фоне эклампсии. Перед операцией состояние крайне тяжелое. АД 80/40 мм рт. ст. Мочи 50 мл. Кровопотеря во время операции оценена в 850 мл. Проведена гемотрансфузия в объеме 1200 мл, введены реополиглюкин - 400 мл, 20% раствор глюкозы - 250 мл, 2,4% раствор эуфиллина - 5 мл, маннитол - 30 г и лазикс - 60 мг. После операции состояние остается очень тяжелым. Самостоятельное дыхание отсутствует. АД 80/40 мм рт. ст., пульс 92-116 уд/мин, аритмия. Анурия. Введен преднизолон в суммарной дозе 150 мг. АД остается 80/70-90/70 мм рт. ст. Эритроциты 2,8¶1012/л, Hb 94 г/л. Инфузионная терапия несколько усилена, дополнительно введены 500 мл крови, реополиглюкин, альбумин, растворы глюкозы и др., еще эуфиллин 10 мл, гидрокортизон 125 мг. Объем мочи за сутки 200 мл.
В данном случае недооценена, своевременно и адекватно не замещена кровопотеря при кесаревом сечении в связи с преждевременной отслойкой нормально расположенной плаценты (недостаточный объем гемотрансфузии, инфузионных сред). На фоне тяжелой гиповолемии, гипотензии, для лечения которых применены глюкокортикоиды, начата интенсивная стимуляция диуреза маннитолом, лазиксом, эуфиллином. В этих условиях она оказалась неэффективной, усугубила тяжесть гемодинамических нарушений.
С целью устранения гемодинамических нарушений, вызванных острой тяжелой гиповолемией, трем больным применены вазопрессоры - мезатон, эфедрин, 10 больным - глюкокортикоиды в суточной дозе 900-2000 мг (!) в пересчете на гидрокортизон. При этом у большинства из них имелась высокая исходная артериальная гипертензия (170/100-200/160 мм рт. ст.), часть перенесла приступы эклампсии и сохранялась повышенная судорожная готовность. Глюкокортикоиды эффективны в профилактике синдрома дыхательных расстройств у новорожденных, родившихся от матерей с тяжелыми формами позднего токсикоза [Ruvinsky E. et al., 1984, и др.]. Имеются данные о гипотензивном влиянии глюкокортикоидов на сосуды плаценты и пуповины, следствием Чего является улучшение плацентарного кровотока [Urban J., Bartnicki J., 1985]. Под влиянием глюкокортикоидов снижается внутричерепное давление, уменьшается отек мозга при токсикозе, особенно при сочетании глюкокортикоидов с маннитолом [Larsen R. et al., 1979; Lips U., 1984]. В то же время результаты лечения R. Larsen и соавт. (1979) нельзя считать удовлетворительными: из 22 больных 6 погибли. Следует отметить, что для профилактики СДР у новорожденного, лечения внутричерепной гипертензии используют невысокие дозы глюкокортикоидов (до 150-200 мг/сут в пересчете на гидрокортизон), учитывая побочный эффект препаратов (повышение АД за счет усиления прессорного действия норадреналина, адреналина, задержка в организме воды, натрия, повышенная экскреция калия, нарушения углеводного обмена с развитием гипергликемии и гиперосмии). Возможно обратное действие глюкокортикоидов на мозговой кровоток - с повышением внутричерепного давления, возникновением судорожных приступов. Риск побочных реакций этих препаратов выше при сопутствующей гипоальбуминемии, характерной для позднего токсикоза. Увеличение концентрации не связанного с белком, биологически активного препарата способствует более интенсивному проявлению всех его фармакологических свойств. Поэтому трудно представить положительное влияние на течение позднего токсикоза беременных замены соответствующего трансфузионно-инфузионного лечения назначением больших и массивных доз глюкокортикоидов.
В нескольких случаях глюкокортикоиды сочетали с назначением ретаболила или ретаболил применяли совместно с панангином, калия хлоридом (последнее - еще до начала инфузионного лечения и назначения диуретических препаратов). Как известно, ретаболил относится к анаболическим стероидам, обеспечивающим положительный азотистый баланс в организме за счет задержки азота. В связи с этим их назначают в периоде реконвалесценции, при астенических синдромах после перенесенных тяжелых состояний, заболеваний. Они не эффективны в острой фазе заболевания, в сочетании с глюкокортикоидами способствуют развитию высокой артериальной гипертензии. Задержка под их влиянием азотистых продуктов и гепатотоксичность делают неприемлемым применение анаболических стероидов при позднем токсикозе беременных.
Выше указано, что при тяжелых формах позднего токсикоза беременных значительно нарушаются структура и функция эритроцита. На этом фоне гиповолемия в связи с геморрагией оказывается дополнительным повреждающим фактором, быстро приводящим к глубокому дефициту ГО как за счет его механического удаления из кровотока в связи с кровотечением, так и за счет усиленного лизиса эритроцитов. Это обстоятельство отчетливо демонстрируют даже обычные лабораторные данные: в процессе родового акта самая высокая концентрация гемоглобина (114,1±7,6 г/л) и самое высокое число эритроцитов (4,02±0,3·1012/л) наблюдаются у больных эклампсией, что, вероятно, связано с гемоконцентрацией. У больных с кровоизлиянием в мозг число эритроцитов ниже (3,2±1,0·1012/л), концентрация НЬ (94,2±10,1 г/л) и цветовой показатель (0,91±0,03) свидетельствуют о развитии острой анемии. Самое низкое число эритроцитов (соответственно 2,98±0,2 и 2,93±0,1·1012/л), гемоглобина (соответственно 80,7±7,4 и 87,4±4,2 г/л), низкий цветовой показатель (соответственно 0,85±0,05 и 0,89±0,03) наблюдаются у рожениц с клиническими проявлениями синдрома ДВС и преждевременной отслойкой нормально расположенной плаценты. У всех больных имеется умеренный лейкоцитоз (11-15·109/л) со сдвигом лейкоцитарной формулы влево, развитием лимфопении, моноцитопении (при геморрагических проявлениях во время ронж), моноцитоза (при эклампсии, кровоизлиянии в мозг), а также анизоцитоз, гипохромия, появляются нормобласты и др.
Гемоконцентрация, развивающаяся у беременных с тяжелыми формами позднего токсикоза, может создавать впечатление о кажущемся благополучии в состоянии глобулярного (эритроцитарного) объема. Ошибочность этого представления и несостоятельность ГО в количественном и качественном отношении демонстрирует динамика показателей периферической крови в послеродовом периоде (табл. 13). Роды на фоне тяжелого позднего токсикоза, как связанные с патологической кровопотерей, так и сопровождающиеся физиологической кровопотерей, оказываются этапом. Меняющим отношения глобулярного и плазменного объемов: дефицит ОП уже не может маскировать дефицит ГО, быстро прогрессирует анемия, что, очевидно, связано с интенсивным лизисом клеток, наблюдается резкое снижение гематокрита (до 0,28±0,03; 0,29±0,01; 0,27±0,01 л/л в 1-7-е сутки послеродового периода).

Таблица 13. Динамика некоторых показателей периферической крови в послеродовом периоде у больных поздним токсикозом (X̄±sx̄)
Представленные данные свидетельствуют о значении адекватной трансфузионно-инфузионной тактики в процессе родов с точным учетом объема кровопотери и своевременным началом его замещения. В число инфузионных сред на этом этапе необходимо включать реологически активные препараты (альбумин, плазму, реополиглюкин), которые способствуют не только поддержанию ОП, но и защите эритроцитов от быстрого разрушения.
Инфузионное лечение послеродового периода, осложненного тяжелым поздним токсикозом, представляет собой еще более сложную задачу, чем таковое во время беременности, так как должно предусматривать устранение тканевого отека, в том числе отека мозга, отека легких, лечение ОПН, ОДН и других нарушений в условиях сниженного глобулярного и плазменного объемов, более тяжелой гипоксии, адаптации гемодинамики к новым условиям в связи с окончанием беременности, началом функции лактации и др.
У больных с крайне тяжелым течением позднего токсикоза в послеродовом периоде наблюдается выраженная степень недостаточности функции жизненно важных органов и систем, нередко прогрессирует коматозное состояние, что может усугубляться медикаментозной загруженностью. При сохранении сознания больные предъявляют жалобы на сухость во рту, жажду, чувство жара и переполнения в конечностях, боли в пояснице, тяжесть в голове, головокружение, головную боль, нарушение зрения. Наблюдаются мраморность, бледность, желтушное окрашивание кожи, иктеричность склер, сухость кожных покровов, повышение температуры тела, двигательное беспокойство и другие признаки гипертонической дегидратации, сохраняются обширные отеки. У большинства больных имеется гиперрефлексия, повышенная судорожная готовность вплоть до повторения приступов эклампсии. В послеродовом периоде нередко прогрессирует ОДН, в результате больные остаются на продолженной и вспомогательной ИВЛ, а при отсутствии ИВЛ наблюдается тахипноэ, в ряде случаев в первые часы после родов развивается отек легких. Стабильно удерживается тахикардия (до 140-160 уд/мин), наблюдаются аритмии (чаще экстрасистолии), в отдельных случаях - брадикардия, частота развития которой прогрессирует к терминальному периоду. На ЭКГ в первые дни послеродового периода отмечают диффузную и очаговую гипоксию миокарда, диффузные метаболические нарушения, а с 3-4-х суток еще электролитные расстройства, признаки перегрузки правого предсердия, замедление внутрижелудочковой проводимости, блокаду ножек предсердно-желудочкового пучка (пучка Гиса), аритмии. Сохраняется высокое АД, но с определенной динамикой: в первые 2-3 дня после родов оно у большинства больных несколько снижается (систолическое АД 150 мм рт. ст. и более отмечено только у 18-30% больных, диастолическое АД 100 мм рт. ст. и более - у 20-28%), с 4-х суток вновь повышается систолическое АД (150 мм рт. ст. и более у 40-60% больных), тогда как диастолическое АД имеет тенденцию к снижению (100 мм рт. ст. и более на 4-7-й и более поздние дни послеродового периода соответственно у 30, 25 и 15% больных). Таким образом, в целом имеется тенденция к увеличению пульсового давления.
У части больных сохраняется и прогрессирует ОПН, у других суточный объем мочи достаточен, соответствует вводимым объемам, но всегда при этом проводят медикаментозную стимуляцию диуреза. Развивается гипохромная анемия (см. табл. 13) с появлением большого числа аномальных форм эритроцитов (анизопойкилоцитоз, гипохромия, полихроматофилия), в том числе в случаях, не сопровождающихся большой кровопотерей во время родов. В течение всего периода удерживается тромбоцитопения (число тромбоцитов 152-60-40-12,5·109/л). У всех больных удерживается лейкоцитоз со сдвигом формулы влево, появлением большого числа миелоцитов, юных, палочкоядерных форм нейтрофилов, развивается лимфопения (более выраженная в случаях кровоизлияния в мозг), токсическая зернистость нейтрофилов, в большом числе появляются плазматические клетки, нормобласты.
У большинства больных во время родов и в первый день послеродового периода удерживается высокая степень протеинурии. В дальнейшем протеинурия уменьшается, а затем вновь нарастает (табл. 14).
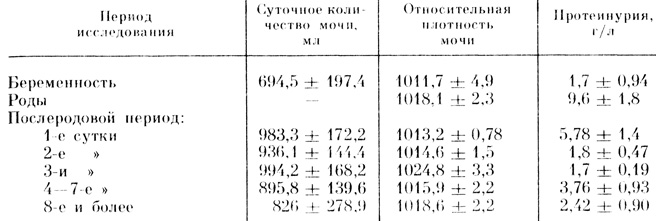
Таблица 14. Динамика некоторых показателей функции почек у родильниц (n=22) с поздним токсикозом (X̄±sx̄)
У некоторых больных потеря белка во время и сразу после родов достигает 26-33 г/л, снижается до 3,3-9,9 г/л ко 2-3-му дню и возрастает до 3,6-16,5 г/л в более поздние сроки, сочетаясь с изогипостенурией, которая имеется фактически у всех больных. О нарушении концентрационно-выделительной функции почек также свидетельствует несоответствие суточного объема мочи низкой относительной плотности.
Таким образом, степень протеинурии в послеродовом периоде выражена значительно больше, чем во время беременности. Точно так же в большей степени выражены признаки нарушения концентрационно-выделительной функции почек. Эти нарушения не компенсирует инфузионное лечение в сочетании с диуретическими препаратами. В то же время реже, чем до родов, наблюдается выраженная лейкоцитурия, но чаще встречается эритроцитурия с появлением измененных эритроцитов (от 15-50 до густо покрывающих поля зрения). Это обстоятельство указывает на тяжелое поражение почечной паренхимы, а также, вероятно, связано у части больных с перенесенным синдромом ДВС. В большом проценте присутствуют клетки почечного эпителия, гиалиновые, несколько реже - зернистые, эпителиальные, восковидные цилиндры, имеются и другие изменения.
Сохраняется гипопротеинемия, которая углубляется с 3-4-х суток, выражена гипоальбуминемия (табл. 15). Редко наблюдается гиперкалиемия: содержание калия остается на нижней границе нормы и ниже нормы даже при парентеральном введении калия хлорида или на фоне нарушенной функции почек. Концентрация калия в эритроцитах также остается в пределах нормальных значений (19,9-24,4 ммоль/л). Вместе с тем к 5-6-му дню послеродового периода и далее развивается тенденция к гипернатриемии, что свидетельствует о развитии гиперосмоляльного синдрома в ответ на проводимое лечение. В пределах нормальных значений (2-2,5 ммоль/л) сохраняется концентрация кальция плазмы, нормальной или несколько сниженной (0,7-1 ммоль/л) - концентрация магния плазмы, повышенной в 2-4 раза - диастаза (α-амилаза) плазмы. Рост мочевины, остаточного азота, креатинина (см. табл. 15) является отражением нарушенной функции почек с обширным поражением почечной паренхимы, а также результатом выраженной дегидратации у части больных. Обращает на себя внимание высокая концентрация глюкозы крови на протяжении всех дней послеродового периода. В отдельных случаях концентрация глюкозы крови достигала 20-21,6 ммоль/л, что свидетельствует о дефектах инфузионного лечения, избыточном введении препаратов глюкозы, плохой ее коррекции, особенно при одновременном применении глюкокортикоидов, тормозящих метаболизм углеводов. Следует подчеркнуть, что глюкоза увеличивает объем воды, которая высвобождается при ее расщеплении. Усваиваясь нервной тканью, она повышает осмотическое давление церебральной жидкости, что может способствовать отеку мозга. При избыточном введении глюкозы возможно развитие гипергидратации и отравление водой [Малышев В. Д., 1985]. Поэтому Н. Н. Расстригин (1978) рекомендует в случаях сохранения артериальной гипертензии или олигурии повторять введение глюкозы не ранее чем через 8-10 ч.
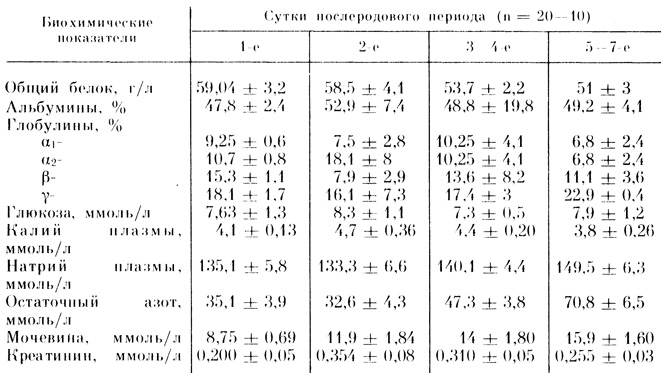
Таблица 15. Некоторые биохимические показатели крови у родильниц с необратимым поздним токсикозом (X̄±sx̄)
У 22 больных в послеродовом (послеоперационном) периоде развились те или иные инфекционные осложнения, чаще связанные с длительной ИВЛ (гнойный трахеобронхит, очаговая и сливная пневмония и бронхопневмония), в двух случаях - тяжелый метроэндометрит. Из мокроты высевали Proteus mirabilis, синегнойную палочку, Klebsiella pnevmonia или палочку Фридлендера, энтерококк; из мочи, лохий - Proteus vulgaris, Escherichia coli, энтерококк, клебсиеллы - в высоких концентрациях, малочувствительные к антибактериальным препаратам.
При выполнении инфузионного, трансфузионно-инфузионного лечения позднего токсикоза необходимо достаточно четко представлять, какие параметры водно-солевого гомеостаза нарушены и подлежат коррекции. Как известно, баланс водных объемов тела (внутриклеточного, внеклеточного с его вне- и внутрисосудистыми разделами) поддерживается за счет осмоляльности, т. е. концентрации растворенных в воде (1 кг) частиц (мосм/кг Н2О). Понятия "миллиосмоль" (мосм) и "миллимоль" фактически являются идентичными для биологических растворов [Рябов Г. А., 1982].
Осмоляльность растворов организма, в том числе плазмы, зависит от растворенных в них ионов (Na+, K+, Ca2+, Mg2+, Cl-, НСО3, РО4-3, SO4-2) и органических соединений (глюкоза, белок, органические кислоты, мочевина). Сумма ммоль/л всех указанных ингредиентов определяет осмоляльность плазмы, которая в норме равна 285-295 мосм/кг Н2О. На осмоляльность резко влияет введение маннитола, сорбитола.
Для практических целей - при проведении инфузионного и другого лечения - об осмоляльности плазмы можно судить, учитывая лишь компоненты, доля которых настолько значительна, что по существу определяет показатель осмоляльности.
R. Alvis и соавт. (1985) для этих целей предлагают следующую формулу:
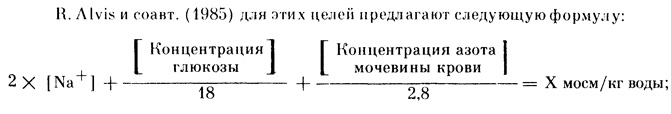
дают следующий пример:
Если эту формулу адаптировать к СИ, она выглядит следующим образом:
Два из трех ингредиентов, включенных в расчет осмоляльности плазмы, наиболее тесно взаимодействуют с объемами общей воды организма, отражают развитие гипергидратации, дегидратации, по существу являются индикаторами указанных состояний. Это глюкоза и натрий плазмы, по которым, следовательно, можно судить о тонусе, давлении плазмы. R. Alvis и соавт. (1985) только их и учитывают при расчете данного показателя:
Эта формула с переводом в СИ выглядит следующим образом:
Повышение концентрации глюкозы, натрия, мочевины способствует развитию гиперосмоляльного синдрома, их снижение (особенно снижение концентрации натрия) - к развитию гипоосмоляльного синдрома [Малышев В. Д., 1985].
Определение концентрации натрия и глюкозы в плазме крови с учетом их отношений и клинического состояния больной позволяет оценить изменения водного обмена: гипернатриемия (концентрация Na+ плазмы более 145 ммоль/л) может свидетельствовать о значительном дефиците воды, например при назначении осмодиуретиков, избирательно удаляющих воду, но сохраняющих в организме натрий; при введении больших объемов солевых (особенно гипертонических) растворов, может также свидетельствовать о задержке воды (внеклеточный отек с увеличением внеклеточного объема жидкости в целом). Гипонатриемия (концентрация Na+ плазмы менее 130 ммоль/л) может быть следствием назначения больших доз салуретиков, что приводит к уменьшению концентрации общей воды, особенно внеклеточного объема, может быть следствием гипергидратации при затрудненном удалении избытков воды, например в связи с ОПН. К гипонатриемии может приводить гипергликемия, так как в этом случае повышение давления внеклеточной жидкости будет способствовать притоку к ней внутриклеточных объемов.
Иными словами, применение различных инфузионных сред, сочетание их с различными диуретиками (салуретики, маннитол) при разных клинических ситуациях, в первую очередь при разном функциональном состоянии почек, будет способствовать разному ответу организма на это лечение. Так, инфузионное лечение в сочетании с нарушенной функцией почек у родильниц с поздним токсикозом способствовало следующим вариантам водно-электролитных нарушений.
Гиперосмоляльный синдром с гипертонической дегидратацией. Отмечен у больных с сохранной функцией почек, особенно длительно находившихся на ИВЛ, при ежедневном введении им умеренных и средних объемов (1200-2000-3000 мл/сут) преимущественно гиперосмотических растворов (до 2/3 или более по отношению к вводимым объемам). Даже умеренная стимуляция диуреза (лазикс 20-80 мг/сут; эуфиллин 2,4% - 20-30 мл/сут; маннитол 30-60 г/сут) приводила при таком инфузионном лечении к гиперосмии с прогрессирующим увеличением концентрации натрия (до 160-170 ммоль/л и выше), снижением концентрации калия (3,3-2,8 ммоль/л и ниже), несмотря на ежедневное введение его содержащих препаратов (натрия хлорид, панангин). Наблюдался также рост концентрации мочевины (до 15-25 ммоль/л и более), остаточного азота (до 50 ммоль/л), глюкозы крови (8,1-11,6 ммоль/л), увеличивалась концентрация общего белка, что было выражено в меньшей степени и при условии отсутствия значительной протеинурии. В случаях, где подобную инфузионную терапию выполняли на фоне патологической кровопотери в родах (1000 мл и более), указанные изменения сопровождались снижением содержания гемоглобина и эритроцитов, несмотря на повторные гемотрансфузии. Это свидетельствовало, что дефицит глобулярного объема был настолько значительным, что гемоконцентрация как признак гипертонической дегидратации не могла проявиться. В других случаях наблюдалась тенденция к увеличению числа эритроцитов и концентрации гемоглобина.
Родильница К. доставлена в связи с приступом эклампсии, который произошел вне лечебного учреждения. На догоспитальном этапе введены магния сульфат (6 г в пересчете на сухой препарат), дроперидол, седуксен. При поступлении состояние крайне тяжелое. Без сознания. Общий отек. АД 160/100 мм рт. ст. Рвота с примесью крови. Реакция зрачков на свет сохранена, d<s. Дан масочный наркоз фторотаном, произведена интубация трахеи, начата ИВЛ, после чего произведено влагалищное исследование: шейка матки сглажена, края зева средней толщины, раскрытие маточного зева 2 см. Произведена амниотомия. Учитывая невозможность быстрого родоразрешения через естественные родовые пути, у больной эклампсией роды срочно закончены операцией кесарева сечения - извлечена девочка массой 2400 г, длиной 49 см с оценкой по Apgar 8/8 баллов. Кровопотеря 700 мл. Во время операции и раннем послеоперационном периоде введено 750 мл эритроцитной массы, 400 мл реополиглюкина, 100 мл новокаина. В течение следующих 16 ч еще 1000 мл растворов: натрия гидрокарбонат, альбумин, 5 и 20% растворы глюкозы. Суточный объем мочи 1600 мл. В течение следующих 3 сут больной вводили по 1300-1500 мл растворов, из них всего введено 2750 мл гипертонических (альбумин, протеин, 20% раствор глюкозы, реополиглюкин) и 1300 изотонических сред (натрия гидрокарбонат, 5% раствор глюкозы, изотонический раствор натрия хлорида и др.). Всего введено за 3 сут 4050 мл растворов, объем мочи за эти дни 4650 мл на фоне ежедневного введения 20 мг лазикса и 20-40 мл 2,4% раствора эуфиллина. Все эти дни больная оставалась в состоянии глубокого сопора. Неврологические симптомы свидетельствовали о поражении на уровне среднего мозга. Отмечены выраженная ангиопатия, отек сетчатки. На 2-е сутки дезинтубирована, но с 4-х суток стали нарастать признаки дыхательной недостаточности, гипоксии (тахипноэ, шумное дыхание, двигательное возбуждение). АД в течение всех дней 160/100-170/100 мм рт. ст., тахикардия до 130 в 1 мин. Вновь переведена на управляемое дыхание. На 5-е сутки выполнена операция экстирпации матки в связи с клиникой метроэндометрита, не поддающегося консервативному лечению. Объем трансфузионно-инфузионного лечения в день операции 2900 мл, из них 1350 мл крови и эритроцитной массы. Продолжена стимуляция диуреза лазиксом и эуфиллином. С 6-7-х суток отмечено снижение суточного объема мочи до 1000, 500 и 250 мл при введении соответственно 2170, 2350, 1800 мл изо- и гипертонических растворов (рис. 18). В течение всего послеродового периода сохраняются клинические и лабораторные признаки синдрома ДВС (повышенная кровоточивость, тромбоцитопения и др.), в связи с чем с 6-х суток применен гепарин по 10 тыс. ЕД/сут. Отсутствует положительная неврологическая динамика, проводятся сеансы вспомогательной ИВЛ, нарастают признаки сердечно-сосудистой недостаточности (тахикардия, артериальная гипотензия, изменения ЭКГ), смерть на 11-е сутки после поступления и родоразрешения.
Рис. 18. Показатели при гиперосмоляльном синдроме с гипертонической дегидратацией у родильницы К., развившемся на фоне инфузионного лечения эклампсии преимущественно гиперосмотическими растворами в сочетании с умеренной или выраженной стимуляцией диуреза. 1 - суточный объем инфузии; 2 - суточный объем мочи; 3 - содержание натрия в плазме; 4 - содержание мочевины в плазме
В данном случае смерть больной наступила в результате необратимых изменений мозга. Не касаясь других аспектов лечения, которое в целом соответствовало клинике заболевания, следует обсудить трансфузионно-инфузионное лечение. Оно не было чрезмерно объемным, включало изо- и гипертонические растворы. Стимуляция диуреза также казалась умеренной. Тем не менее уже к 4-5-му дню развился гиперосмоляльный синдром, что выражалось в прогрессивном увеличении концентрации натрия плазмы (197-160 ммоль/л), концентрации мочевины плазмы при относительно сохраненной функции почек (13,2-15 ммоль/л в сравнении с 7,7-6 ммоль/л при поступлении и в 1-е сутки после родоразрешения), увеличении концентрации глюкозы крови (10,4 ммоль/л). При этом в пределах нормальных значений или ниже нормы оставалась концентрация калия плазмы (3,6-3,0-2,6 ммоль/л), несмотря на ежедневное введение калия хлорида, начиная со 2-х суток послеродового периода. О гиперосмии свидетельствовала относительно высокая для такой тяжести состояния концентрация общего белка (63-66-69-62 г/л), тем более, что у больной сохранялась постоянная протеинурия в пределах 3,3-2,9-1-2,6-3,1 г/л. Характерным для гипертонической дегидратации было увеличение относительной плотности мочи (с 1015 до 1024 и 1048). Тем не менее, несмотря на развитие гиперосмоляльного синдрома, наблюдалось прогрессивное снижение гемоглобина со 139 г/л при поступлении до 106 г/л на 5-е и 92 г/л на 9-е сутки, несмотря на гемотрансфузии при первой и второй операции. Гиперосмоляльный синдром прогрессировал к 6-8-му дню послеродового периода: концентрация Na плазмы - 200-194 ммоль/л, концентрация мочевины - 20-35 ммоль/л, осмоляльность плазмы - 436 мосм/кг воды. Эти изменения, безусловно, в основном определялись инфузионной тактикой с введением большого объема гиперосмотических растворов, без достаточной компенсации потерь воды (потери воды с мочой, при ИВЛ, за счет высокой лихорадки). Можно полагать, что развитие тяжелого гиперосмоляльного синдрома было основной причиной снижения суточного объема мочи в последние 3 сут.
Развитие гиперосмоляльного синдрома с гипертонической дегидратацией в результате аналогичной инфузионной тактики в сочетании со стимуляцией диуреза отмечено еще у 14 больных: у всех ежедневные инфузии проводили в объеме 1300-3600 мл, включая гипертонические (полиглюкин, реополиглюкин, альбумин, маннитол, аминопептид, аминон, аминокровин, гипертонические растворы глюкозы и др.) и гипотонические растворы (лактасол, раствор Рингера - Локка, изотонический раствор натрия хлорида, 5% раствор глюкозы и др.). Одновременная интенсивная стимуляция диуреза с ежедневным применением эуфиллина, лазикса (до 140-200 мг/сут), маннитола (15-60 г/сут) способствовала тому, что суточный объем мочи соответствовал, а часто превышал вводимые объемы. Выключенное сознание, отсутствие энтеральных поступлений воды, пищи приводили к углублению нарушений водно-электролитного баланса, которые регистрировались на ЭКГ, при лабораторном исследовании: концентрация калия оставалась сниженной или удерживалась на нижних границах нормальных, значений за счет ежедневных введений 4-8 г калия хлорида (3,3-3,2-2,9-4 ммоль/л), концентрация натрия была во всех случаях высокой (150-160-170 ммоль/л и более). На верхних границах нормы или выше нормы (6,3-10,8-12,5 ммоль/л и более) была концентрация глюкозы плазмы, высоким и прогрессивно увеличивающимся - содержание азотистых шлаков (мочевина 8-15-22 ммоль/л; остаточный азот 50-53 ммоль/л; креатинин до 0,52-0,69 ммоль/л). Различной была концентрация общего белка - у части больных высокая (80-84 г/л), у части - с постепенной тенденцией к повышению (59-74-81 г/л), у части, несмотря на постепенный рост, концентрация в целом оставалась сниженной (35-46-57 г/л). Не отмечено высоких концентраций гемоглобина и числа эритроцитов. Эти показатели оставались в пределах нормальных значений или были умеренно снижены (гемоглобин 100-110 г/л, эритроциты 3,0-3,4·1012/л), или наблюдалась тяжелая прогрессирующая анемия (содержание гемоглобина 50-64-75-80 г/л; эритроцитов 1,6-2,2-2,6·1012/л). В то же время, в отличие от родильниц, развитие гиперосмоляльного синдрома у беременных женщин приводит к гемоконцентрации с увеличением содержания эритроцитов и гемоглобина соответственно до 4,2-4,4·1012/л и 130-140 г/л, в отдельных случаях выше.
Таким образом, инфузионная тактика с включением большого объема гипертонических растворов, в том числе синтетических коллоидов, при одновременной эффективной медикаментозной стимуляции диуреза, продленной ИВЛ, отсутствие энтерального поступления воды и пищевых продуктов, введение средних и больших доз глюкокортикоидов неизбежно приводили к развитию гиперосмоляльного синдрома с гипертонической дегидратацией, начиная с 1-2-х суток лечения. В последующем продолжение этой лечебной тактики способствовало углублению водно-электролитных нарушений. Можно думать, что нарастание тяжести анемии у части больных, не имевших сопутствующих геморрагических осложнений, объясняется повреждением и легким разрушением эритроцитов, как и других клеток организма, теряющих воду за счет гипертонической дегидратации.
В целом гиперосмоляльный синдром с гипертонической дегидратацией характеризовали выраженная гипернатриемия (160-190 ммоль/л и более), гипергликемия (8-12 ммоль/л), постепенное значительное повышение мочевины крови (15-30 ммоль/л), а также некоторое увеличение концентрации общего белка, постепенное снижение суточного объема мочи с повышением ее относительной плотности (1024-1048), прогрессирующая анемия, пролонгирование клинических и лабораторных признаков синдрома ДВС. У больных в течение ряда суток сохранялись коматозное состояние, повышенная судорожная готовность, ОДН. Осмоляльность плазмы составляла 400 мосм/кг воды и более. Например: (Na 190 ммоль/л × 2) + (глюкоза 12 ммоль/л) + (мочевина 15 ммоль/л) = 407 мосм/кг воды. Тоничность плазмы достигала 380-390 мосм/кг воды. Например: (Na 190 ммоль/л × 2) + (глюкоза 12 ммоль/л) = 392 мосм/кг воды.
Попутно следует отметить не только нецелесообразность, но даже опасность включения в программу инфузионной терапии у больных поздним токсикозом растворов для парентерального питания типа аминона, аминопептида, аминокровина. Они не являются инфузионными средами и, следовательно, не отвечают тем требованиям, которые предъявляются к растворам при лечении токсикоза, способны вызывать аллергические реакции, тем более у больных поздним токсикозом. Кроме того, нагрузка аминокислотами дополнительно осложняет азотистый обмен и выведение азотистых шлаков пораженными почками.
Не совсем ясным остается смысл широкого назначения в инфузионном лечении гидрокарбоната натрия, особенно если учесть, что фактически у всех больных уже в 1-е сутки послеродового периода развивается метаболический алкалоз (гл. 2). Препарат вводили без контроля КОС, а иногда и при наличии номограммы, свидетельствующей о метаболическом и респираторном алкалозе у больной. Натрия гидрокарбонат в количестве 4-37 г/сут применен во время беременности, чаще в послеродовом периоде у 8 больных, причем всегда в сочетании с назначением салуретиков, хотя сопутствующее выведение калия само по себе способствует развитию метаболического алкалоза. Кроме того, натрия гидрокарбонат не показан при дыхательной недостаточности, так как процесс ощелачивания сопровождается высвобождением угольной кислоты, для элиминации которой необходимы дополнительные объемы легочной вентиляции [Малышев В. Д., 1985].
Гипоосмоляльный синдром, или изоосмоляльное состояние с гипотонической дегидратацией, развился у 7 больных с сохранной функцией почек, которым проводили с 1-х суток послеродового периода массивную инфузионную терапию - 3000-6000 мл/сут, с введением большого числа как изотонических растворов (раствор натрия гидрокарбоната 4-5%, изотонический раствор натрия хлорида, 0,5% раствор новокаина, гемодез, 5% раствор глюкозы и др.), так и гипертонических сред (плазма, альбумин, растворы глюкозы 10 и 20%, полиглюкин, реополиглюкин, раствор сорбитола, маннитола и др.). Инфузии дополняли назначением больших доз диуретиков (лазикс до 340 мг/сут), эуфиллина. У этих больных с 1-х суток послеродового периода в клинике преобладали симптомы отека мозга, которые прогрессировали: тяжелая преэклампсия с соответствующей симптоматикой, повышенная судорожная готовность, повторные приступы эклампсии (у 3 больных), массивное кровоизлияние в мозг (у 2 больных). Рано развивалась и удерживалась высокая лихорадка (38-41°С). Артериальная гипертензия колебалась от 210/130-190/120 до 140/70 мм рт. ст. с тенденцией к снижению по мере увеличения продолжительности послеродового периода. Нарастала тахикардия (до 150-160 в 1 мин). На ЭКГ определяли диффузную гипоксию миокарда, синусовую тахикардию, симптомы замедления внутрижелудочковой проводимости. ОДН проявлялась обычно на 2-4-е сутки, выражалась в тахипноэ, появлении патологических ритмов дыхания, двигательном возбуждении и др.
Суточный объем мочи вначале соответствовал вводимым объемам растворов, но с 3-4-х суток, иногда несколько позже, начинал снижаться, составлял 60-30% от вводимых объемов. Характерной была очень низкая относительная плотность мочи (редко 1014-1017, чаще 1009-1006-1004). Довольно быстро нарастала концентрация мочевины (14-60 ммоль/л), остаточного азота (27-94 ммоль/л и более), креатинина (0,22-0,31 ммоль/л). В пределах нормы оставалась концентрация калия (3,3-4,5 ммоль/л), концентрация натрия была или на нижней границе нормы, или сниженной (130-104 ммоль/л). Концентрация глюкозы плазмы не превышала 3,3-5,5 ммоль/л. Значительно снижалась концентрация общего белка (36-40-48 г/л), несмотря на ежедневное введение содержащих белок препаратов (альбумин, протеин, сухая плазма и др.). У некоторых больных сохранялись клинические проявления синдрома ДВС: кровоточивость десен, геморрагическое отделяемое из носовых ходов и др., наблюдалась тромбоцитопения (80-84·109/л). Почти у всех больных резко прогрессировала анемия: исходное число эритроцитов (в 1-е сутки после родов) соответствовало 2,8-4,2·1012/л, в дальнейшем снижалось до 3,2-2,7-1,6·1012/л. Концентрация гемоглобина в 1-е сутки послеродового периода была 128-114-91 г/л, в дальнейшем снижалась до 100-89-74-51 г/л. Эти изменения, очевидно, также в определенной степени объяснялись нарушением структуры эритроцита и его лизисом вследствие развития гипоосмоляльного синдрома. Сохранялись клинические проявления отека мозга, нарастала клиника сердечно-сосудистой недостаточности, что приводило к гибели на 2-15-е сутки после родов.
Родильница Н. Роды на фоне тяжелой преэклампсии (АД 170/100 мм рт. ст., головная боль, нарушения зрения, протеинурия 6,6 г/л и др.) проведены с применением фторотана, дроперидола, седуксена, магния сульфата и других препаратов. Выполнена экстракция за тазовый конец 1-го плода (масса 2150 г, длина 45 см, оценка по шкале Apgar 8/8 баллов). Второй плод в головном предлежании родился без оперативных вмешательств (масса 2100 г, длина 44 см, оценка по шкале Apgar 7/8 баллов). Ручное отделение и выделение последа, швы на промежность. Кровопотеря 250 мл. Через 2,5 ч после родов на фоне сохраняющейся клиники преэклампсии развился приступ эклампсии. Дан наркоз фторотаном, больная переведена на ИВЛ, продолжено введение магния сульфата, повторно применены седуксен, дроперидол, другие наркотические средства, транквилизаторы, проводится ганглионарная блокада пентамином. Тем не менее сохраняется судорожная готовность, повторяются приступы эклампсии в течение суток. Инфузионная терапия в 1-е сутки: всего введено 6000 мл, из них 375 мл крови, 2800 мл гипертонических растворов (полиглюкин, реополиглюкин, альбумин, протеин, маннитол и др.) и 3200 мл изотонических сред (лактасол, трисоль, 5% раствор глюкозы и др.). Суточный объем мочи 6800 мл на фоне стимуляции диуреза: лазикс 220 мг, маннитол 60 г, эуфиллин 2,4% 40 мл.
На 2-е сутки сохраняются глубокая кома, ангиоретинопатия, повышенная судорожная готовность, повторился приступ эклампсии. Продолжено соответствующее лечение. За сутки введено 3000 мл растворов, из них 250 мл крови и 1600 мл гипертонических растворов. Суточный объем мочи 2600 мл. Стимуляция диуреза: лазикс 160 мг, маннитол 30 г, эуфиллин 2,4% 30 мл. На 3-4-е сутки состояние остается крайне тяжелым. Гипорефлексия. Гипертермия. АД 185/100-130/80-140/100 мм рт. ст. Дыхание самостоятельное через интубационную трубку. Соответственно на 3-й и 4-е сутки введено 3200 и 2350 мл растворов, из них 2400 и 1300 мл гипертонических и 250 мл крови. Суточные объемы мочи 3500 и 2650 мл. Стимуляция диуреза в эти сутки соответственно лазиксом 40 мг, маннитолом 60 г, эуфиллином 20 мл и лазиксом 20 мг, эуфиллином 30 мл.
На 5-е сутки сознание отсутствует, дыхание через интубационную трубку, шумное, до 30 в 1 мин. В легких рассеянные влажные хрипы. Наложена трахеостома. АД 160/90-150/90 мм рт. ст. Введено 3200 мл растворов, из них 2550 мл гипертонических и 250 мл донорской крови. Суточный объем мочи 2400 мл на фоне эуфиллина, лазикса. На 6-е сутки глубокая кома, сохраняется общая отечность, АД 150/90-160/90 мм рт. ст., пульс до 120 уд/мин. Продолжено то же лечение, внезапная остановка сердца, реанимация не эффективна.
Причиной смерти больной явились необратимые изменения мозга. Однако здесь заслуживает обсуждения один из аспектов лечения - инфузионная терапия. Она, безусловно, была излишней по объему, особенно в 1-е сутки, но также и в последующие дни, сопровождалась массивной стимуляцией диуреза. Диуретическая терапия, полиурия с потерей больших количеств калия и натрия в сочетании с введением больших объемов гипертонических растворов (протеин, альбумин, маннитол и др.) способствовали развитию изоосмотической дегидратации: концентрация натрия плазмы сохранялась в пределах 134-141 ммоль/л, концентрация калия в течение всего времени была нормальной и ниже нормы (3,1-2,8-3,3 ммоль/л), поддерживалась ежедневным введением калия хлорида в дозе 4-8 г (рис. 19). Оставалась в пределах нормы концентрация глюкозы крови (4,4-4,9 ммоль/л). Концентрация мочевины, постоянно находившаяся в пределах верхней границы нормы, в последние 2 сут стала нарастать (6,6-6,8-7,1 ммоль/л). Со 2-х суток оставалось сниженным содержание общего белка (52-56 г/л), несмотря на ежедневное введение достаточного количества содержащих его препаратов и некоторое снижение степени протеинурии (2,6-4,9-3,6 г/л).
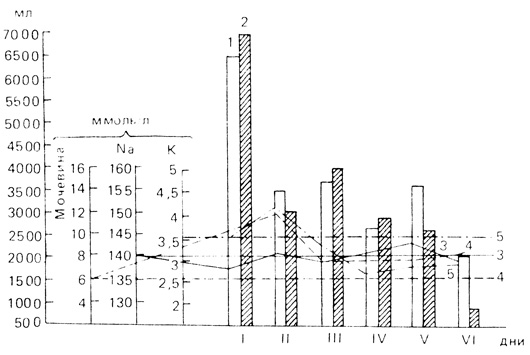
Рис. 19. Показатели при гипоосмоляльном синдроме с гипотонической дегидратацией у родильницы Н., развившемся на фоне ежедневных инфузий больших объемов изо- и гипертонических растворов в сочетании с интенсивной стимуляцией диуреза. 1-4 - как на рис. 18; 5 - содержание калия в плазме
Хотя больной проводили фактически ежедневные гемотрансфузии, концентрация гемоглобина и число эритроцитов имели тенденцию к снижению (соответственно со 114 до 100 г/л и 4,2 до 3,2-3,6·1012/л), сохранялась тромбоцитопения (60-90·109/л), гиперфибриногенемия (5,8-7,5 г/л).
В 1-е сутки послеродового периода на фоне достаточно высокой артериальной гипертензии больной однократно применен полиглюкин (400 мл) в сочетании с маннитолом. Полиглюкин в суточной дозе 400-1200 мл использован в инфузионном лечении позднего токсикоза еще у 12 больных. Следует отметить, что полиглюкин - эффективное средство лечения острой гиповолемии при кровопотере, травме, не показан больным поздним токсикозом в связи с его способностью повышать внутричерепное давление, выраженным объемным эффектом. О необходимости осторожного подхода к назначению полиглюкина при позднем токсикозе в связи с его способностью стимулировать артериальную гипертензию предупреждают В. И. Грищенко (1977) и другие авторы.
В отличие от полиглюкина маннитол, оказывая избирательное дегидратационное действие на мозг, снижает внутричерепное давление, не влияет значительно на осмотический потенциал тканевой жидкости мозга. Учитывая это обстоятельство, Н. Н. Расстригин, А. И. Алексеева (1975) отдают предпочтение маннитолу перед другими дегидратационными препаратами, включая гипертонический раствор глюкозы, сухую плазму, альбумин, протеин и др. Е. Pippmann (1974) также считает целесообразным начинать лечение при токсикозе с маннитола, затем уже добавляя диуретики. У. Ретцке, Р. Шварц (1973) сообщают, что маннитол в дозе 20 г в сочетании с низкомолекулярным декстраном (15% - 500 мл), помимо увеличения объема мочи, способствует снижению диастолического АД, увеличению ударного и минутного объема сердца, снижению периферического сосудистого сопротивления. Последний эффект фактически аналогичен таковому при сочетанном введении той же дозы декстрана со 100 г сорбитола.
Тем не менее в процессе клинического испытания маннитола выявлены четкие противопоказания для его назначения - это высокая артериальная гипертензия (систолическое АД 160 мм рт. ст. и более, диастолическое - 100 мм рт. ст. и более) и анурия. Применение маннитола в суточной дозе до 60 г имело место еще у 3 больных: при высокой артериальной гипертензии (170/110 мм рт. ст.), анурии и некомпенсированной кровопотере (2 л) в раннем послеродовом периоде, в сочетании с полиглюкином на фоне АД 260/180 мм рт. ст. У 2 больных при высокой артериальной гипертензии развилось кровоизлияние в мозг. Поэтому применение маннитола должно проводиться с четким представлением об имеющихся к нему противопоказаниях, лучше в небольших дозах (20-30 г/сут), под постоянным контролем АД.
Фактически всем больным с нарушением водно-электролитного баланса как по типу гипертонической дегидратации, так и по типу гипо- и изотонической дегидратации применяли различное антибактериальное лечение, которое обычно состояло из чередования антибиотиков тетрациклинового, пенициллинового ряда, цефалоспоринов (кефзол, цепорин, цефамезин и др.) и аминогликозидов (мономицин, гентамицин и др.), в ряде случаев в больших дозах (12 г/сут цепорина, 160 мг/сут гентамицина и др.). Следует подчеркнуть гепатотоксический, нефротоксический эффект тетрациклинов, аминогликозидов, недопустимость введения больших доз антибиотиков на фоне почечной недостаточности в связи с повышением их концентрации в крови и, следовательно, увеличением побочного действия. Кроме того, многие "петлевые" диуретики (лазикс, урегит) сами по себе оказывают нефротоксическое действие, которое еще усиливается при их сочетании с антибиотиками, особенно с аминогликозидами и цефалоспоринами в связи со снижением экскреции антибиотиков из-за их конкуренции с диуретиками за секреторный механизм [Сивков И. И. и др., 1978].
В целом гипоосмоляльный синдром или изоосмотическое состояние с гипотонической дегидратацией характеризуют выраженная гипонатриемия (125-140 ммоль/л и менее), нормальный уровень глюкозы крови (3-6 ммоль/л), постепенное повышение концентрации мочевины (14-60 ммоль/л), значительное прогрессивное снижение концентрации общего белка (36-48 г/л), значительная прогрессирующая анемия, постепенное снижение суточного объема мочи (до 60-30% от вводимых объемов), низкая относительная плотность (1004-1015), пролонгирование клинических и лабораторных признаков синдрома ДВС (кровоточивость, число тромбоцитов 80-85·109/л), выраженная артериальная гипертензия, высокая лихорадка, тахикардия, ОДН, кома в связи с отеком мозга, кровоизлиянием в мозг, повторные приступы эклампсии. Осмоляльность плазмы равна 270-280 мосм/кг воды и меньше. Например: (Na плазмы 102 ммоль/л × 2) + (глюкоза плазмы 3 ммоль/л) + (мочевина плазмы 30 ммоль/л) = 237 мосм/кг воды. Тоничность плазмы 220-210 мосм/кг воды и меньше. Например: (Na 102 ммоль/л × 2) + (глюкоза 6 ммоль/л) = 110 мосм/кг воды.
Следует отметить, что гипотоническая дегидратация в тяжелом варианте может развиться в случаях, где не проводят инфузионное лечение позднего токсикоза, но назначают диуретические препараты. Она способствует углублению гемореологических нарушений у беременных женщин с относительным дальнейшим увеличением ГО, критическим снижением ОП, что облегчает клиническую реализацию синдрома ДВС, в частности развитие преждевременной отслойки нормально расположенной плаценты, развитие острых тромбозов и других сосудистых нарушений в витальных органах. Так, J. Koster, С. Schneider (1977) наблюдали у беременной с эклампсией выраженную гемоконцентрацию с гематокритом 0,58 л/л, что закончилось острым тромбозом сосудов мозга. В анализируемой группе диуретические препараты (лазикс в суммарной дозе 240 мг, маннитол, эуфиллин) были применены у беременной женщины в срок 27/28 нед с постэклампсической комой, высокой артериальной гипертензией (200/120-190/120), высокой протеинурией (6,6 г/л) и тяжелой гемоконцентрацией (число эритроцитов 5·1012/л, концентрация гемоглобина 190 г/л). Это способствовало острой отслойке нормально расположенной плаценты с тяжелым нарушением гемостаза, коррекция которого оказалась неэффективной, несмотря на экстирпацию матки и проведение всего комплекса соответствующей терапии.
Гиперосмоляльный синдром с гипотонической гипергидратацией отмечен у 10 больных с ОПН, анурией. Суточные объемы растворов для инфузий у этих больных составляли 2000-4650 мл, суточный объем мочи 0-800 мл, или 0-7-30% от объема вводимых растворов. Стимуляцию диуреза в основном проводили лазиксом (250-1200 мг/сут), эуфиллином, в одном случае - маннитолом. Больным применяли те же сочетания гипер- и гипотонических растворов (альбумин, плазма, полиглюкин, реополиглюкин, маннитол, 5, 10, 20% растворы глюкозы, изотонические растворы натрия хлорида и др.). На фоне общего крайне тяжелого состояния, обусловленного отеком мозга и другой патологией, обращали на себя внимание два момента: частота развития отека легких, постоянная клиника "влажного легкого" с ОДН, влажными рассеянными хрипами и быстрое развитие тяжелой артериальной гипотензии со снижением АД с 220/100-190/120 до 120/80-110/60-90/50 мм рт. ст. и менее. Одновременно наблюдались тахикардия, тахиаритмия. На ЭКГ регистрировали диффузную гипоксию миокарда, признаки перегрузки и др. В этой группе отмечена самая короткая продолжительность жизни после окончания родов: 7 больных погибли в 1-3-й сутки, остальные - соответственно на 4-, 6- и 11-е сутки. Во всех случаях причиной смерти фактически была острая, внезапная остановка сердца. Концентрация калия была или на верхней границе нормы, или несколько повышенной (3,9-4,2-5,6-6,6-7,1 ммоль/л), концентрация натрия оставалась в пределах нормальных значений или была снижена (138-126-105 ммоль/л и ниже). Наблюдалось значительное увеличение концентрации азотистых шлаков: содержание остаточного азота нарастало с 24,4-37,7 ммоль/л до 70-115-127,6 ммоль/л, концентрация креатинина достигала 0,488-0,761 ммоль/л. Во всех случаях имелась гипопротеинемия, причем, как правило, с прогрессивным значительным снижением концентрации общего белка в плазме в динамике наблюдения (например, с 84 до 35 г/л; с 66 до 52-46-42 г/л и др.). Разной была концентрация глюкозы крови (от 5,5 до 8-10,8 и 21 ммоль/л), что, вероятно, зависело от индивидуальных особенностей инфузионного лечения. Обращало на себя внимание низкое содержание гемоглобина (105-94-80-66 г/л) при относительно большем числе эритроцитов (3,5-3,28-2,14·1012/л). Это отмечалось фактически у всех больных и, очевидно, было связано с гипергидратационными изменениями эритроцита. Соответственно низким был цветовой показатель (0,80-0,85). В целом гиперосмоляльный синдром с гипотонической гипергидратацией характеризовали нормальное или сниженное содержание натрия плазмы (138-120-105 ммоль/л, иногда ниже), умеренная гиперкалиемия или нормальная концентрация калия плазмы (3,9-4,2-6,6-7,1 ммоль/л), нормальная концентрация глюкозы, но чаще выраженная гипергликемия (5-8-21 ммоль/л), резкое повышение содержания мочевины плазмы (38-115-130 ммоль/л), быстрое значительное снижение общего белка (84-66-42-35 г/л), быстрое снижение концентрации гемоглобина (80-66 г/л) при более высоком содержании эритроцитов (3,5-2,2·1012/л) и низком цветовом показателе (0,85-0,80 и ниже). Несмотря на значительную стимуляцию диуреза петлевыми диуретиками (лазикс), сохраняется олигоанурия, суточный объем мочи составляет 0-7-30% от вводимых объемов, сохраняется отек мозга, часто развивается клиника отека легких, прогрессируют артериальная гипотензия, тахикардия, аритмия. Осмоляльность плазмы 340-390 мосм/кг воды. Например: (Na 130 ммоль/л × 2) + (глюкоза 20 ммоль/л) + (мочевина 110 ммоль/л) = 390 мосм/кг воды. Тоничность плазмы 230-260 мосм/кг воды. Например: (Na 120 ммоль/л) + (глюкоза 20 ммоль/л) = 260 мосм/кг воды.
Таким образом, инфузионное лечение позднего токсикоза в сочетании со стимуляцией диуреза может способствовать развитию различных вариантов нарушений водно-электролитного обмена: гиперосмоляльного синдрома с гипертонической дегидратацией, гипоосмоляльного синдрома или изоосмоляльного состояния с гипотонической дегидратацией, гиперосмоляльного синдрома с гипотонической гипергидратацией. Каждый из этих вариантов нарушений имеет свои характерные клинические особенности 1 свою особую лабораторную характеристику, знание которой позволяет вносить в лечение своевременную коррекцию.
Чрезвычайно опасным вариантом нарушений водно-электролитного обмена является гипотоническая гипергидратация при выполнении инфузионного лечения на фоне ОПН. В связи со сложностями удаления избытка водных объемов у больных прогрессирует общий и органный отек, в том числе повторяется клиника отека легких, возможна острая остановка сердца. Другие варианты нарушений водно-электролитного обмена также представляют значительную опасность, особенно в случаях их запоздалой диагностики. При проведении интенсивного лечения, направленного на регуляцию водного и электролитного баланса, у родильниц с тяжелыми формами позднего токсикоза, отеком витальных органов определенная роль принадлежит диуретическим препаратам. Однако следует считать недопустимой стимуляцию диуреза (как в случаях эффективного, так и неэффективного ответа) в течение ряда дней большими дозами лазикса и других препаратов: На фоне имеющихся нарушений, разрегулированного гомеостаза они могут сами явиться причиной острой сердечной недостаточности и остановки сердца, облегчают развитие этого осложнения под влиянием других факторов. Необходимо также учитывать, что гипокалиемию, развивающуюся при назначении диуретических препаратов из группы салуретиков, осмодиуретиков, всегда усиливает тяжелое поражение печени при токсикозе; применение в этих условиях кардиотонических средств, сердечных гликозидов повышает частоту сердечных аритмий, усиливает степень недостаточности миокарда.
Очень тщательный подход необходим к выбору объемов инфузионного лечения и подбору инфузионных сред, причем требования к ним становятся различными в период беременности и в послеродовой период. В то же время выбор объема интенсивного лечения, в том числе инфузионного, во время родов, в первые часы послеродового периода часто определяет исход при тяжелом позднем токсикозе. Поэтому как на этапе беременности, родового акта, так и в послеродовом периоде недооценка тяжести заболевания и, следовательно, неполноценный объем лечения может иметь необратимые последствия. Представляется, что такая недооценка ситуации, в том числе клиники отека мозга. ОДН. ОПН, иногда способствует запоздалой их диагностике, запоздалому началу лечения как на этапе беременности, родов, так и в послеродовом периоде. Поэтому на всех этапах ведения больных поздним токсикозом должен существовать, помимо клинического, и более подробный лабораторный скрининг с динамической оценкой обязательного набора тестов. К ним мы относим учет объема мочи, определение степени протеинурии, гематокрита, гемоглобина, общего белка, мочевины, глюкозы, калия и натрия плазмы, подсчет числа тромбоцитов, эритроцитов. Эти и некоторые другие показатели позволяют своевременно обратить внимание на неблагоприятное развитие клиники заболевания, дефекты инфузионного и другого лечения.
При тяжелом полиорганном поражении при позднем токсикозе, создающем порочный круг, трудно выделить в имеющейся клинике степень заинтересованности тех или иных систем. Изменена у больных восприимчивость к лекарственным препаратам и их переносимость, нарушены их распад и выведение метаболитов, часто сопутствуют другие осложнения, в первую очередь акушерские кровотечения. Также высока частота родоразрешающих оперативных вмешательств, лапаротомий в связи с геморрагиями. Поэтому в интенсивном лечении позднего токсикоза обязательно постоянное совместное участие акушеров и анестезиологов также при постоянной помощи других специалистов - невропатологов, окулистов, терапевтов, нефрологов, знакомых с акушерской патологией. Это участие необходимо на всех этапах - от момента поступления беременной, роженицы с тяжелым токсикозом в акушерский стационар до полного выведения из этого состояния в послеродовом периоде. Анестезиологическое пособие у больных поздним токсикозом включает многие моменты: проведение наркоза и аналгезии при оперативном и самопроизвольном родоразрешении других оперативных вмешательствах, профилактику и лечение гипоксии, дыхательной недостаточности с проведением ИВЛ, инфузионно-трансфузионное лечение, направленное на нормализацию кислотно-основного состояния и поддержание
гомеостаза, профилактику и лечение острой недостаточности витальных органов, устранение нарушений гемостаза, выведение больных из терминального состояния. По понятным причинам большинство указанных вопросов находится в компетенции анестезиологов, в силу чего акушеры часто отдают больных тяжелым поздним токсикозом в их полное ведение после окончания родов, родоразрешающих операций. В то же время при курации больных поздним токсикозом в процессе беременности часто полностью отсутствует вмешательство врача-анестезиолога даже в виде обычного осмотра для представления о больной, так как всегда велик в этих случаях риск неотложных оперативных и других вмешательств, следовательно, высока вероятность проведения экстренного наркоза, других анестезиологических пособий. Очевидно, что правильной остается совместная тактика с разной долей участия каждого специалиста на разных этапах.
Так, в целях лечения гипоксии, постэклампсической энцефалопатии, ОДН, ОПН необходима ИВЛ, которая способствует нормализации гемодинамики, устраняет тяжелые нарушения гемостаза и др. [Расстригин Н. Н., Суханова Л. П., 1976; Воронин К. В., Маневич Л. Е., 1986, и др.]. По данным Е. А. Ланцева (1979) и др., продолжительность ИВЛ (часы, сутки) зависит от стабилизации гемодинамических показателей, устранения симптомов дыхательной недостаточности и появления адекватного самостоятельного дыхания. Попытки прекратить ИВЛ раньше нормализации указанных параметров приводят к возобновлению ОДН, приступов эклампсии [Spies H., 1974, и др.]. Это же подтверждает анализ настоящего материала: ранняя экстубация - сразу по окончании операции кесарева сечения, ампутации, экстирпации матки в связи с кровотечением, на фоне сохраняющейся гипоксии, прогрессирующего постгипоксического отека мозга, анурии, клиники неразрешенного геморрагического шока с незамещенной кровопотерей, нестабильной гемодинамикой, неполной коррекцией геморрагических проявлений синдрома ДВС, при отсутствии адекватного спонтанного дыхания была произведена у 17 больных. В 3 случаях это привело к развитию терминального состояния и смерти, в других случаях выполнена срочная повторная интубация с повторным переводом на ИВЛ. У некоторых больных ранняя экстубация совмещалась со значительной загрузкой наркотическими препаратами, что также способствовало быстрому нарастанию тяжести ОДН.
Имеют значение сроки начала ИВЛ: у нескольких больных к ней приступили с известным опозданием, несмотря на крайне тяжелую клинику при поступлении: артериальная гипертензия до 200/130 мм рт. ст., иногда больше, в сочетании с анурией, отеком мозга; постэклампсическая кома, массивная кровопотеря в связи с преждевременной отслойкой плаценты, ОДН. На значение своевременного начала ИВЛ обращают внимание Н. Н. Расстригин (1978) и другие авторы. По данным Н. Н. Расстригина, А. И. Алексеевой (1975), показаниями для перевода на ИВЛ у беременных с тяжелыми формами позднего токсикоза являются острые нарушения функции витальных органов, приступы эклампсии, кома, нарушения внешнего дыхания (тахипноэ 40 в 1 мин и более), изменения ритма дыхания, симптомы гиповентиляции в виде возбуждения, цианоза, повышенного потоотделения на фоне артериальной гипертензии, предстоящее оперативное вмешательство. У больных в коматозном состоянии ИВЛ следует начинать до появления признаков дыхательной недостаточности, что обеспечивает профилактику необратимой постгипоксической энцефалопатии, необратимых изменений других органов.
Не всегда достаточным было анестезиологическое обеспечение родов, операции кесарева сечения. Бережное родоразрешение беременных с тяжелыми формами позднего токсикоза предусматривает обязательную защиту ЦНС от болевой импульсации, поступающей из малого таза, от матки. В то же время анестезия в родах, тем более осложненных поздним токсикозом, является достаточно сложной задачей: применение наркотических (морфин, промедол, омнопон, фентанил) и ненаркотических (анальгин и др.) анальгетиков не обеспечивает достаточного обезболивающего эффекта; наркотические анальгетики не показаны в связи с их угнетающим влиянием на внешнее дыхание новорожденного с развитием респираторного дистресс-синдрома. Особую опасность в этом отношении представляет фентанил. Использование ингаляционных (закись азота, фторотан, эфир и др.) и неингаляционных (барбитураты короткого действия, сомбревин, виадрил Г, кетамин и др.) анестетиков имеет свои показания и противопоказания (в том числе при позднем токсикозе), которые учитывают в каждом случае: кроме того, некоторые из них также неблагоприятно влияют на плод и новорожденного.
Теоретически одним из наиболее удачных методов обезболивания родов и связанных с ними оперативных вмешательств является перидуральная (эпидуральная) анестезия, при которой анестетики (чаще тримекаин) вводят на уровне LI-II или LII-III, не прокалывая твердую мозговую оболочку спинного мозга, чем достигается блокада спинномозговых нервов и их корешков [Бакулева Л. П. и др., 1977; Newsome L. et al., 1986, и др.]. Учитывая эффект перидуральной анестезии, Ф. Я. Банщик и соавт. (1977), В. В. Абрамченко, Е. А. Ланцев (1985) считают ее методом выбора при анестезиологическом обеспечении родов, осложненных тяжелыми формами позднего токсикоза. По данным Е. А. Ланцева (1979), длительная перидуральная блокада в процессе родов, осложненных поздним токсикозом, способствует снижению АД, улучшению функции миокарда, нормализации биоэлектрической активности мозга. Однако метод не получил широкого распространения в акушерской практике, что, видимо, связано с возможностью развития ОДН, острой сердечно-сосудистой недостаточности, перидурита и некоторых других осложнений.
В последние годы при ведении беременных, рожениц, родильниц с тяжелыми формами позднего токсикоза широко используют нейролептик дроперидол, который обеспечивает нейровегетативную блокаду, вызывает состояние психоэмоциональной индифферентности, способствует увеличению диуреза, в сочетании с рауседилом обеспечивает стойкий гипотензивный эффект, снижает периферическое сосудистое сопротивление [Расстригин Н. Н. и др., 1975]. Препарат оказывает противошоковое действие, снижает возможность осложнений, связанных с "полным желудком", хорошо сочетается с диазепамом. Последний проявляет достаточно выраженным противосудорожное действие, дает слабый гипотензивный эффект, максимум которого наступает через 30-40 мин после парентерального применения препарата. Потенцирует действие других седативных, транквилизирующих средств, достаточно медленно (в течение 2-3 сут) выводится из организма, что следует учитывать при родоразрешении больных поздним токсикозом: проницаемость диазепама через плаценту создает риск развития респираторного дистресс-синдрома у новорожденного. Суточная доза препарата у больных поздним токсикозом не должна превышать 40-60 мг. По данным Н. Н. Расстригина, А. И. Алексеевой (1975), не показано назначение диазепама больным в коматозном состоянии.
В последние годы возобновился интерес к длительно действующим барбитуратам (фенобарбитал) в связи с их противосудорожным и снотворным действием. Эти свойства фенобарбитала (люминала) были основанием для его применения у беременных с поздним токсикозом еще в 20-30-е годы путем подкожного и внутривенного введения в максимальной разовой дозе до 0,6 г или энтерального приема по 0,03 г через каждые 8 ч [Мандельштам А. Э., Каплун Э. М., 1935; Власов-Денисов В. Н., 1957]. В настоящее время показана эффективность сочетания фенобарбитала (0,25-0,5 г внутривенно при медленном введении, суточные дозы 5-6 мг/кг) с магния сульфатом для предотвращения эклампсии [Pritchard J., Pritchard A., 1975; Knuppel R., Montenegro R., 1983, и др.].
Применение любых наркотических веществ, в том числе барбитуратов, требует особенно осторожного отношения при острой почечной недостаточности, нарастании в крови азотистых шлаков в связи с повышением чувствительности нервной ткани к их угнетающему действию. С учетом представленных данных можно сказать, что применение анальгетиков, наркотических, нейролептических и других средств, воздействующих на нервную систему, У больных поздним токсикозом нередко было избыточным в процессе беременности, послеродового периода, осложненного приступами эклампсии, ОДН, ОПН, но, с другой стороны, явно недостаточным в процессе родов. При анестезиологическом обеспечении родов, помимо недостаточной аналгезии при влагалищном родоразрешении, операции кесарева сечения, в некоторых случаях применены препараты, не показанные у беременных и рожениц на фоне высокой артериальной гипертензии, не оправдано попутное использование некоторых других медикаментозных средств.
Так, у 15 рожениц в процессе родов применены лишь промедол, анальгин, кратковременно - ингаляционные анестетики, чаще фторотан. Следует подчеркнуть нежелательность его использования близко к окончанию родов: в связи с токолитическим действием на миометрий он может явиться причиной гипотонического кровотечения, тем более у рожениц с поздним токсикозом. Кроме того, препарат гепатотоксичен, обладает способностью угнетать функцию миокарда, снижать сердечный выброс.
У части рожениц было недостаточным обезболивание при влагалищном исследовании, в периоде изгнания, при выполнении влагалищных родоразрешающих операций, ручном обследовании полости матки в раннем послеродовом периоде.
Родильница К. доставлена после домашних родов, осложненных эклампсией, преждевременной отслойкой нормально расположенной плаценты на фоне тяжелого нелеченного позднего токсикоза (женскую консультацию не посещала, беременность скрывала). Перед транспортировкой (в специализированной машине, с акушерской реанимационной бригадой) врачом проведена интубация трахеи, осуществлен перевод на ИВЛ на фоне введения дроперидола, натрия оксибутирата, масочного наркоза триленом. В процессе транспортировки повторился приступ эклампсии. При поступлении в акушерский стационар состояние крайне тяжелое, АД 170/110 мм рт. ст., продолжается кровотечение из половых путей, в связи с чем выполнена операция ручного обследования полости матки. Обезболивание при операции: фентанил 0,1 мг (2 мл 0,005% раствора), пипольфен 2,5% - 2 мл.
Роженица П. поступила с началом родовой деятельности на фоне нелеченного позднего токсикоза длительностью 4-6 нед. АД 170/100-165/100 мм рт. ст. Анурия. Начата инфузионная терапия (20% раствор глюкозы, 4% раствор натрия гидрокарбоната, 0,25% раствор новокаина), введены лазикс (20 мг), эуфиллин (2,4% - 10 мл), дроперидол (5 мг), диазепам (10 мг). Через 6 ч на фоне удовлетворительной родовой деятельности развился приступ эклампсии. Дополнительно введены дроперидол (10 мг), седуксен (10 мг), начат курс магнезиальной терапии, дан масочный наркоз закисью азота с кислородом. Еще через 2 ч, во II периоде родов, повторился приступ эклампсии. Роды закончены операцией наложения акушерских щипцов, перинеотомией, ручным удалением задержавшихся частей последа, зашиванием раны промежности. Указанные оперативные вмешательства выполнены под внутривенным наркозом сомбревином 100 мг в сочетании с поверхностным наркозом закисью азота с кислородом.
В первом из приведенных случаев у больной в состоянии тяжелого геморрагического шока и постэклампсического статуса проводимая ИВЛ обеспечивала возможность более эффективного обезболивания ингаляционными и неингаляционными анестетиками. Между тем применен пипольфен, который является антигистаминным препаратом, не оказывает аналгезирующего действия, лишь умеренно потенцирует эффект других препаратов, в связи с чем используется лишь как дополнительное средство при введении в наркоз. Кроме того, эффект, потенцирующий действие анальгетиков, развивается медленнее, чем это необходимо для выполнения срочного внутриматочного вмешательства.
Во втором случае, учитывая крайнюю тяжесть состояния больной, анурию, развитие эклампсии, необходим был перевод на ИВЛ и окончание родов операцией кесарева сечения. Выбор иного метода родоразрешения не был дополнен адекватным анестезиологическим обеспечением. К аналгезии фактически приступили только после приступа эклампсии (масочный наркоз закисью азота), так как примененные в начале родов дроперидол и седуксен анальгезирующими свойствами не обладают. Их сочетание оказывает благоприятное действие в процессе родов, осложненных поздним токсикозом (гипотензивный, транквилизирующий эффект), тем не менее, не заменяет анальгетиков.
Не всегда достаточной была аналгезия при операции кесарева сечения, о чем свидетельствовало повышение АД к концу операции; например, проведение основного наркоза закисью азота с кислородом в соотношении 1:1 со следами фторотана (0,5 об. %), использование при эклампсии и тяжелой преэклампсии кеталара (кетамина) в качестве вводного и основного наркоза (в последнем случае с добавлением ингаляционных анестетиков). В то же время известно, что кетамин оказывает гипертензивное действие, повышает внутричерепное давление, усиливает тонус поперечнополосатой мускулатуры.
Степень риска при лапаротомии (кесарево сечение, ампутация, экстирпация матки) у больных эклампсией, преэклампсией всегда довольно значительна, так как к витальным нарушениям добавляется операционная травма. Риск операции может быть несколько меньше, если есть время на подготовку и осмотр больной врачом-анестезиологом в динамике. Это позволяет корригировать применение препаратов, воздействующих на мозг, уменьшает вероятность передозировки наркотических, анальгетических, нейролептических и других средств, позволяет оптимально подобрать средства для наркоза во время операции.
И. В. Ильин и соавт. (1977) указывали в числе причин, способствующих летальным исходам при тяжелых формах позднего токсикоза, острую дыхательную недостаточность как вследствие нарушений трахеобронхиальной проводимости (аспирация желудочного содержимого), так и в результате наркотической депрессии Дыхательного центра при назначении избыточных количеств наркотических препаратов. Избыточное применение этих и других средств, воздействующих на ЦНС, способствует углублению гипоксии, затрудняет выход из коматозного состояния. Следует отметить, что излишнее применение наркотических и других препаратов часто заключается не только и не столько в превышении допустимых разовых и суточных доз одного какого-либо средства, сколько в сочетании большого числа лекарственных форм без учета возможного потенцирующего действия. Например, в течение суток больной вводят фентанил 1,5 мг (30 мл 0,005% раствора), дроперидол 47,5 мг (19 мл 0,25% раствора), натрия оксибутират 8000 мг (40 мл 20% раствора), диазепам 150 мг (30 мл 0,5% раствора), магния сульфат 25% 60 мл, тиопентал-натрий 800 мг и периодически добавляют наркоз фторотаном; или в течение суток вводят фентанил 0,4 мг (8 мл 0,005% раствора), дроперидол 15 мг (6 мл 0,25% раствора), пипольфен 0,15 г (6 мл 2,5% раствора), тизерцин 0,15 г (6 мл 2,5% раствора), диазепам 65 мг (13 мл 0,5% раствора), натрия оксибутират 16000 мг (80 мл 20% раствора), виадрил 2300 мг, дипидолор 45 мг (6 мл 0,75% раствора). Не вдаваясь в дальнейшее обсуждение этой проблемы, более очевидной специалистам-анестезиологам, хотелось бы в заключение отметить, что хорошее анестезиологическое пособие при тяжелом позднем токсикозе беременных существенно помогает, тогда как неадекватное, без учета особенностей ответа организма беременной на введение наркотических средств, тем более в условиях повреждения органов, участвующих в метаболизме и выведении лекарственных препаратов (печень, почки, легкие), может серьезно повредить.
|
ПОИСК:
|
Саенко Инна Александровна, автор статей
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://m-sestra.ru/ 'M-Sestra.ru: Сестринское дело'